Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Lipophagie ou lipolyse autophagique
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

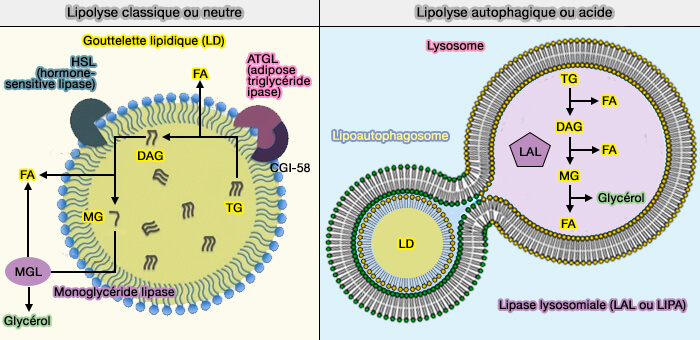
La lipophagie est la voie de dégradation lysosomale des gouttelettes lipidiques (LD), mécanisme alternatif à la lipolyse pour la mobilisation des lipides stockés en réponse aux besoins cellulaires et aux stimuli de stress.
(Figure : vetopsy.fr)
C'est la lipase lysosomale (LAL ou LIPA), localisée comme son nom l'indique dans les lysosomes, qui régroupe toutes les activités enzymatiques des lipases cytoplasmiques des LD.
Vue d'ensemble de la lipophagie
Bien que l'hydrolyse des triglycérides (TG) et des esters de cholestérol (CE) stockés dans les gouttelettes lipidiques cytoplasmique (cLD) ait été principalement attribuée aux actions des lipases cytosoliques, la voie de dégradation lysosomale des gouttelettes lipidiques cytoplasmiques (cLD) est un mécanisme alternatif de mobilisation des lipides stockés en réponse aux besoins cellulaires et stimuli externes (Lipids, lysosomes, and autophagy 2016 et Regulation and Functions of Autophagic Lipolysis 2016).
Par exemple, dans le foie de souris à jeun, l’ATGL (Adipose TriGlycéride Lipase ou PNPLA2) représente moins de 50% de l’activité de la triacylglycérol hydrolase, ce qui suggère l’existence de lipases supplémentaires et éventuellement de mécanismes moléculaires différents pour la mobilisation des acides gras des réserves hépatiques de triacylglycérol.

(Figure : vetopsy.fr d'après Jaishy et Abel)
1. La lipophagie, i.e. l'autophagie des gouttelettes lipidiques, et la lipolyse sont des voies conservées au cours de l'évolution, essentielles à la survie cellulaire pendant les périodes de privation de nutriments pour fournir des substrats énergétiques. Les deux processus sont :
- supprimés dans des conditions d'apport suffisant ou excessif de nutriments (obésité),
- augmentés en réponse à un apport limité d'énergie (pendant le jeûne ou la famine), fournissant des acides gras libres comme carburant pour la β-oxydation mitochondriale pour répondre aux besoins énergétiques cellulaires.
a. La formation de sites de contact membranaire (MCS) entre les LD et les lysosomes, i.e. MCS LD-lysosomes, joue un rôle direct et indirect dans la lipophagie (Friend or Foe: Lipid Droplets as Organelles for Protein and Lipid Storage in Cellular Stress Response, Aging and Disease 2020).
Les lysosomes (vacuoles chez la levure) jouent un rôle majeur dans le catabolisme, le recyclage des déchets cellulaires, l'excrétion des déchets et la signalisation cellulaire.
(Figure : vetopsy.fr d'après Geltinger et col)
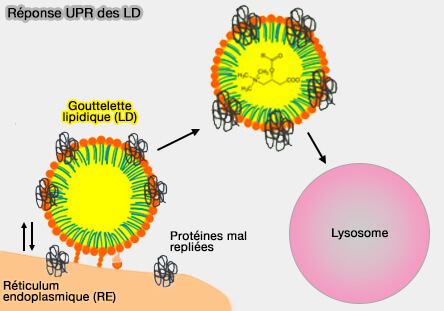
b. La lipophagie, outre son rôle dans le jeûne, est aussi essentielle à la mobilisation des lipides liés aux LD en réponse à d'autres facteurs de stress, ainsi qu'à la dégradation des lipides excédentaires ou toxiques ou des protéines dépliées qui sont stockées et séquestrées dans les LD pendant le stress du RE (Lipid droplet autophagy during energy mobilization, lipid homeostasis and protein quality control 2018).
La lipophagie apporte aussi des stérols et d'autres lipides de la LD à la membrane vacuolaire en phase stationnaire chez la levure (Membrane dynamics and protein targets of lipid droplet microautophagy during ER stress-induced proteostasis in the budding yeast, Saccharomyces cerevisiae 2021).
2. La lipophagie fait appel à plusieurs mécanismes qui peuvent se produire dans la même cellule :
- la macroautophagie, mécanisme principal chez les mammifères,
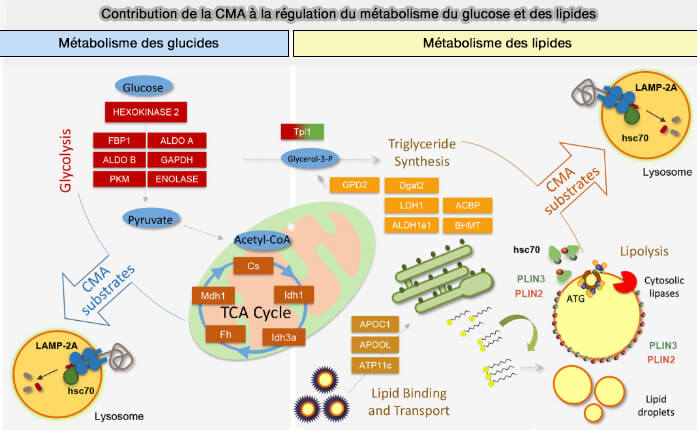
- l'autophagie médiée par un chaperon ou CMA, i.e. Chaperone-Mediated Autophagy (Role of chaperone-mediated autophagy in metabolism 2016),
- la microautophagie ou microlipophagie (µLP), principalement étudiée et comprise chez la levure.
(Figure : vetopsy.fr d'après Tasset et Cuervo)
Ces formes d'autophagie :
- diffèrent par le mode d'administration du substrat aux vésicules autophagiques et utilisent des médiateurs moléculaires distincts spécifiques au type de cellule et au facteur de stress environnemental,
- nécessitent la reconnaissance des gouttelettes lipidiques et la réorganisation de la surface des gouttelettes lipidiques pour faciliter l’amarrage des composants utilisés dans le processus d’autophagie.

Vous pouvez lire : The Lipolysome-A Highly Complex and Dynamic Protein Network Orchestrating Cytoplasmic Triacylglycerol Degradation (2020).
Macroautophagie

La macrolipophagie est le processus qui séquestre les gouttelettes lipidiques recouvertes de Plin2 dans les autophagosomes, avec la présentation ultérieure aux lysosomes dans lesquels les lipides neutres sont ensuite hydrolysés par la lipase lysosomale (LAL ou LIPA).
- La macroautophagie est le mécanisme principal chez les mammifères.
- C'est un processus de recyclage en masse des organites, contrairement à la CMA (Chaperone-Mediated Autophagy).
La macroautophagie s'effectue dans divers types de cellules :
- adipocytes (Sustained activation of autophagy suppresses adipocyte maturation via a lipolysis-dependent mechanism 2020),
- hépatocytes, entérocytes, macrophages, neurones (Autophagy in the CNS and Periphery Coordinate Lipophagy and Lipolysis in the Brown Adipose Tissue and Liver 2016).
Plin1 et Rab7
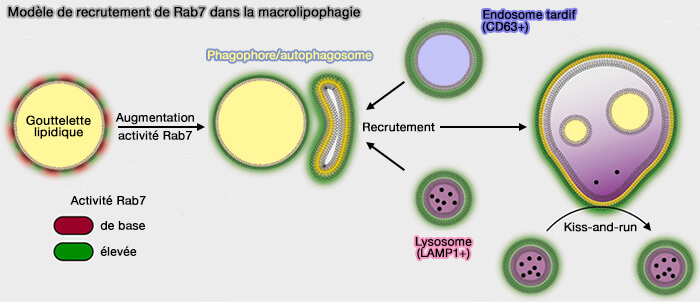
Rab7, une petite GTPase, présente à la surface des gouttelettes lipidiques semble jouer un rôle précoce pour initier la lipophagie dans les adipocytes et les hépatocytes (The small GTPase Rab7 as a central regulator of hepatocellular lipophagy 2015).
(Figure : vetopsy.fr d'après Schroeder et coll )
1. Dans des conditions basales, Rab7 serait associé faiblement aux gouttelettes lipidiques recouvertes de Plin1, i.e. interaction indépendante de Plin1.
2. La stimulation des récepteurs β-adrénergiques, avec activation ultérieure de la PKA et phosphorylation de Plin1, initierait la lipophagie (β-adrenergic receptor-stimulated lipolysis requires the RAB7-mediated autolysosomal lipid degradation 2013).
- L'inactivation de Plin1, i.e. phosphorylée, augmenterait l'association de Rab7 et de la protéine membranaire intégrale lysosomale LAMP1 (Lysosomal-associated membrane protein 1) avec des gouttelettes lipidiques pour l'amélioration de la lipolyse.
- Plin1 non phosphorylée bloque l'amarrage de Rab7 sur les gouttelettes lipidiques et joue donc un rôle protecteur dans l'inhibition de la lipophagie.
Autres Plins
1. Plin2 protège aussi les lipides neutres stockés dans les gouttelettes lipidiques contre les lipases cytosoliques (The constitutive lipid droplet protein PLIN2 regulates autophagy in liver 2017).
- La surexpression de Plin2 protège les gouttelettes lipidiques hépatiques de la lipolyse autophagique.
- Le déficit en Plin2 réduit la teneur en gouttelettes lipidiques en améliorant la lipolyse autophagique dans le foie des souris et dans les cellules d'hépatome en culture.

Plin1 et Plin2 régulent négativement la lipolyse autophagique en agissant comme une barrière physique, plutôt qu'en recruter des médiateurs clés de l'autophagie dans les gouttelettes lipidiques.
2. Plin3 régule également la macroautophagie de manière dépendante de TORC1 (A Mammalian Target of Rapamycin‐Perilipin 3 (mTORC1‐Plin3) Pathway is essential to Activate Lipophagy and Protects Against Hepatosteatosis 2021).
CMA (Chaperone-Mediated Autophagy)
Contrairement à la macroautophagie, processus de recyclage en masse des organites, y compris des gouttelettes lipidiques, l'autophagie médiée par des protéines chaperonnes (CMA) ciblent généralement les protéines cytosoliques solubles et fait intervenir deux acteurs principaux (The coming of age of chaperone-mediated autophagy 2018) :
- Hsc70 (HSPA8),
- LAMP2A (Lysosomal-associated membrane protein 2A).

L'autophagie médiée par des protéines chaperonnes (CMA) est étudiée dans un chapitre spécifique.
Dans des conditions de disponibilité limitée en nutriments, l'autophagie médiée par un chaperon (CMA) est le principal mécanisme d'élimination des Plin2 et Plin3 des gouttelettes lipidiques.
Pour la plupart des cellules du corps, les gouttelettes lipidiques sont recouvertes par Plin2 et Plin3 et la lipolyse autophagique nécessite l'élimination de ces périlipines des gouttelettes lipidiques pour que LAL puissent accéder aux lipides centraux.
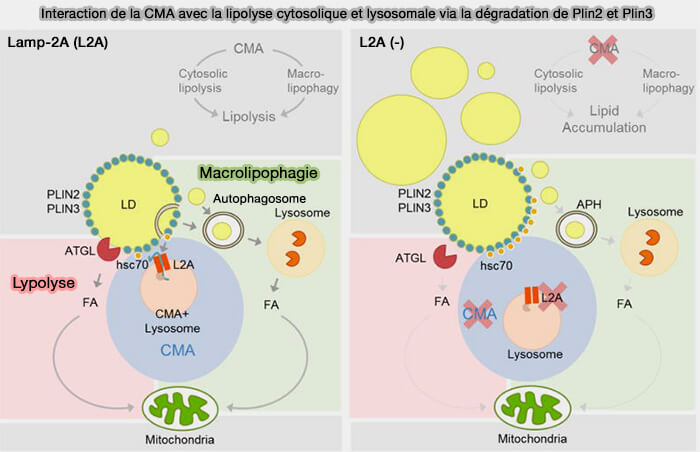
(Figure : vetopsy.fr d'après Kaushik et et Cuervo)
1. Les protéines du substrat CMA contiennent un motif pentapeptidique canonique, KFERQ, qui est sélectivement reconnu et lié par la protéine de choc thermique Hsc70 (HSPA8) qui interagit avec LAMP2A pour importer les protéines dans les lysosomes en vue de leur dégradation.
a. La Plin2 et Plin3 de la souris contiennent respectivement des séquences pentapeptidiques apparentées, i.e. LDRLQ et SLKVQ respectivement (Degradation of lipid droplet-associated proteins by chaperone-mediated autophagy facilitates lipolysis 2015).
Lors de mutation de ces motifs, par exemple en SLKAA, la liaison de Hsc70 à Plin2 sur les gouttelettes lipidiques est très faible, i.e. Plin2 reste associée de manière stable aux gouttelettes lipidiques.
b. La liaison de Plin2/3 à HSPA8 favorise leur phosphorylation par l'AMPK (AMP-activated protein kinase).
2. Les Plins phosphorylées sont délivrées à LAMP2A (Lysosomal-associated membrane protein 2A), protéine membranaire qui facilite la translocation des substrats CMA de la surface à la lumière lysosomale (AMPK-dependent phosphorylation of lipid droplet protein PLIN2 triggers its degradation by CMA 2016).
3. Lorsque la CMA est bloquée, plutôt que de s'accumuler dans le cytosol, le complexe Plin/hsc70 reste lié à la surface des gouttelettes lipidiques bloquant l'accès des lipases et des protéines de lipophagie.
a. Le blocage de la CMA hépatique explique, en partie l'hépatostéatose i.e. les lipides s'accumulent dans les hépatocytes et ne sont pas mobilisés pour être distribués à d'autres organes lors d'insuffisance de nutriments, bien que d'autres processus puissent intervenir (Role of chaperone-mediated autophagy in metabolism 2016)
b. Plus largement, les dérèglements de la CMA provoquent (The coming of age of chaperone-mediated autophagy 2018) :
- des phénomènes neurodégénératifs,
- des cancers.
b. Cette rétention bloque donc la lipolyse classique ET la lipolyse autophagique, car l'élimination de Plin2/3 de la surface des LD favorise l'association des LD avec les lipases cytosoliques comme l'ATGL qui catalysent la libération de acides gras (FA) des triglycérides (TG)
Microautophagie ou microlipophagie (µLP)
1. La microautophagie ou microlipophagie LD (µLP) est principalement étudiée chez la levure.

Nous ne développerons pas ce chapitre et vous pouvez lire un développement complet dans : Touch and Go: Membrane Contact Sites Between Lipid Droplets and Other Organelles (2022).
Les LD établissent un contact direct avec le lysosome/vacuole et une absorption partielle ou totale des LD dans le lysosome/vacuole au niveau des sites d'invagination dans la membrane lysosomale/vacuolaire.
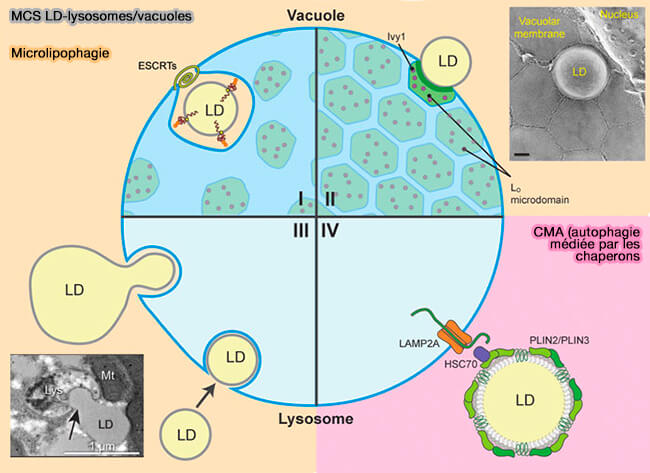
(Figure : vetopsy.fr d'après Liao et et coll)
2. La microautophagie LD (µLP) est aussi présente dans les cellules de mammifères et le mécanisme sous-jacent est encore largement inconnu (Direct lysosome-based autophagy of lipid droplets in hepatocytes 2020).
La formation de MCS entre les LD et les lysosomes se produit en l'absence de structures de type autophagosome à double membrane.
a. Rab7 semble jouer dans la formation de MCS LD-lysosome dans les hépatocytes (The small GTPase Rab7 as a central regulator of hepatocellular lipophagy 2015).
- Lors de jeûne, on observe une augmentation du recrutement de Rab7 dans les LD et une augmentation des MCS entre les LD et les compartiments de dégradation, i.e. lysosomes, MVB (corps multivésiculaires) et endosomes tardifs.
- L'épuisement de Rab7, inhibe ces interactions et provoque une accumulation de MVB élargis et regroupés et une inhibition globale de la dégradation des LD.
b. Rab7 aurait ici un rôle direct différent de celui de la macroautophagie où il se lie à LAMP1 (Lysosomal-associated membrane protein 1).
Retour aux gouttelettes lipidiques
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


