Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Biogenèse
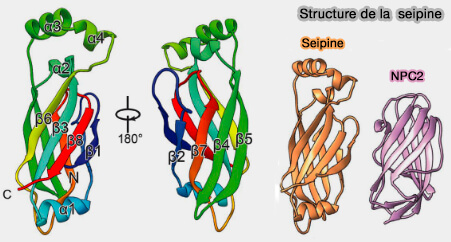
Seipines : structure
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La seipine avec LDAF1 forme un complexe protéique d’assemblage des LD (LDAC ou LD Assembly protein Complexes) qui est impliqué dans la biogenèse des gouttelettes lipidiques (LD).
Vue d'ensemble de la seipine
1. La seipine est une protéine membranaire intégrale homo-oligomère du réticulum endoplasmique (RE) qui se concentre sites de contact membranaire (MCS) :
- avec les gouttelettes lipidiques cytoplasmiques, i.e. MCS LD-RE (Dietary fatty acids promote lipid droplet diversity through seipin enrichment in an ER subdomain 2019),
- avec les mitochondries, i.e. MAM.
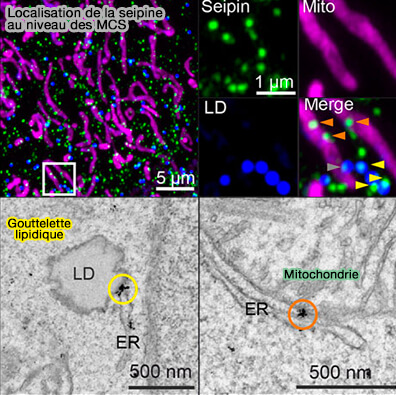
(Figure : vetopsy.fr d'après Salo)
a. La seipine est exprimée de manière ubiquitaire, mais en grande quantité dans les neurones corticaux des lobes frontaux, dans les motoneurones de la moelle épinière, les testicules et le tissu adipeux.
Remarque : la seipine est aussi retrouvée dans les gouttelettes lipidiques nucléaires (nLD) dont le rôle est le maintien de l'homéostasie des phospholipides (SEIPIN: A Key Factor for Nuclear Lipid Droplet Generation and Lipid Homeostasis 2020).
b. La seipine, dont le gène est BSCL2, est incriminée dans la lipodystrophie congénitale de type 2 de Berardinelli-Seip (BSCL2), i.e. sa déficience provoque une absence de tissu adipeux (adipocytes) et le stockage des lipides dans tous les tissus, provoquant ainsi une hypertrophie musculaire, une résistance à l'insuline, une hypertriglycéridémie et une stéatose hépatique (La vie sans tissu adipeux : les lipodystrophies généralisées congénitales ; causes, physiopathologie et prise en charge thérapeutique 2021).

Vous pouvez lire : Seipin-still a mysterious protein? (2023) et Étude des fonctions de la seipine dans l’adipocyte mature : Rôles dans l’homéostasie calcique, l’activité mitochondriale et le profil lipidique (2021).
2. D'autres protéines sont impliquées dans la définition de l'étape initiale de la biogenèse des LD, car les LD et le RE restent en contact même lorsque la seipine est absente (
(Figure : vetopsy.fr d'après Salo et coll)
Structure de la seipine
Structure générale
Plusieurs isoformes seraient présentes, une de 287 résidus, une de 398 et la dernière de 462.
(Figure : vetopsy.fr d'après Whalter et coll)
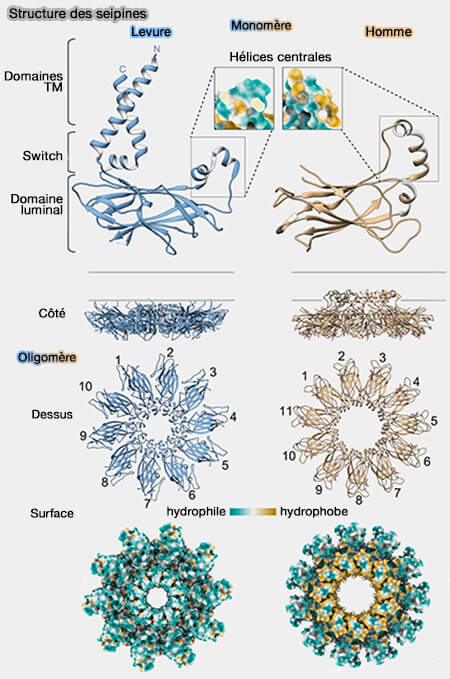
1. La structure de la seipine, i.e. isomère de 398 résidus, celle des autres n'étant pas encore bien connue, comprend :
- une extrémité N-terminale cytosolique, i.e.1-26,
- deux domaines transmembranaires (TM), i.e. 27-47 et 247-270,
- un domaine luminal, i.e. boucle localisée dans la lumière du RE qui contient un site de N-glycosylation, et qui est relié aux TM par une région de commutation (switch) qui permet des changements de conformations, i.e. conformations A et B,
- une extrémité C-terminale cytosolique, i.e. 271-398.
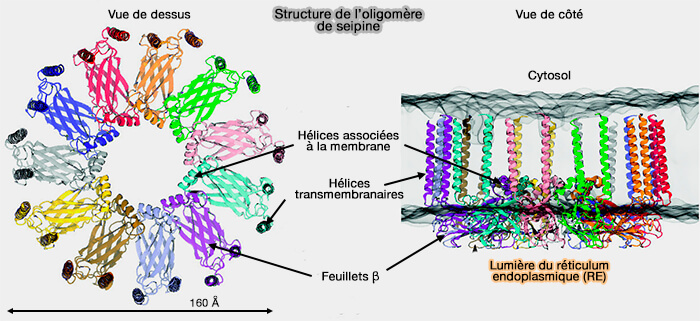
2. La seipine forme des homo-oligomères, de 11 ou 12 sous-unités chez l'homme, i.e. complexe toroïdal d'environ 150 Å de diamètre.
On trouve 10 sous-unités chez la levure et 12 chez la drosophile.

Vous pouvez lire : Cryo–electron microscopy structure of the lipid droplet–formation protein seipin (2018).
Domaine luminal
Au sein du complexe, chaque domaine luminal se replie en un domaine sandwich α/β ressemblant aux domaines de liaison lipidique comme NPC2 (
Structure générale du domaine luminal
La fonction du domaine luminal reste incertaine (Seipin forms a flexible cage at lipid droplet formation sites 2022).
(Figure : vetopsy.fr d'après McPhee et coll)
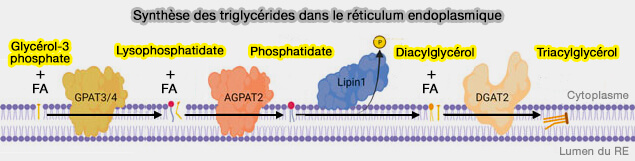
1. Le domaine luminal se lierait aux phospholipides (PL) chargés négativement, comme par exemple l'acide phosphatidique ou PA (Human SEIPIN Binds Anionic Phospholipids 2018).
a. Les enzymes GPAT et AGPAT fabriquent l'acide phosphatidique (PA) ou phosphatidate, un intermédiaire clé pour la synthèse de tous les glycérolipides.
Le PA est également un lipide non bicouche qui peut avoir un impact sur les propriétés biophysiques du RE (
(Figure : vetopsy.fr d'après Sui et coll)
b. Cette liaison pourrait éviter leur surproduction, à l’origine de la modification de la membrane du RE, i.e. de ses propriétés structurales et physiologiques, ce qui provoque une l'abolition de l'adipogenèse.
Ce dysfonctionnement provoquerait des défauts du regroupement des protéines sur les domaines membranaires et des courbures du RE, entraînant ainsi un défaut de bourgeonnement de la gouttelette lipidique depuis le RE.
c. La seipine peut fonctionner pour contrôler la concentration locale de PA par au moins deux mécanismes (The biogenesis of lipid droplets: Lipids take center stage 2019).
- Elle séquestrerait le PA dans son domaine de liaison lipidique conservé au cours de l'évolution.
- Elle contrôlerait négativement l’activité GPAT.
L’interaction seipine-PI(3)P (phosphatidylinositol 3-phosphate) nécessite des recherches plus approfondies.
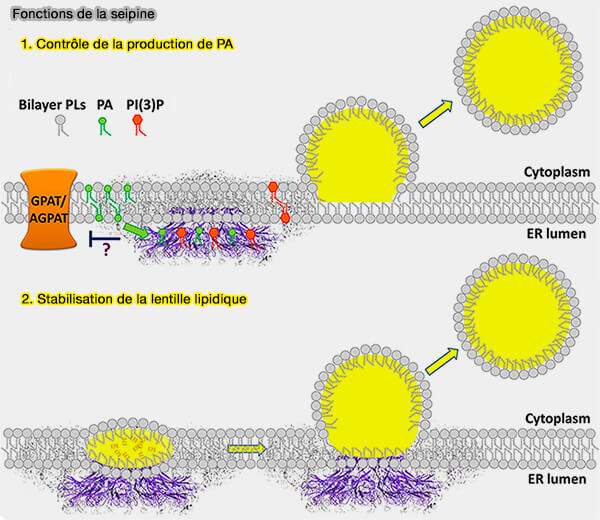
(Figure : vetopsy.fr d'après Gao et coll)
2. Le domaine luminal pourrait principalement servir d'ancrage structurel pour la formation des LD, en positionnant les éléments clés de la protéine, i.e. les hélices hydrophobes au niveau de la membrane (pour la mouche et la seipine humaine) et les hélices TM au niveau du cou naissant.
Remarque : les diamètres des anneaux sont similaires chez toutes les espèces étudiées.
3. La seipine se lie aussi à plusieurs enzymes impliquées dans la synthèse des TG, i.e. GPAT3, AGPAT2 et lipine-1 et son rôle est encore à préciser (
Hélices centrales hydrophobes
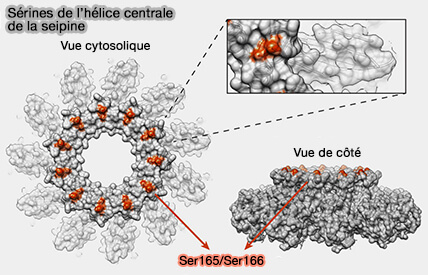
(Figure : vetopsy.fr d'après Chung et coll)
Chez l'homme et la mouche, mais pas chez la levure, les domaines luminaux forment un anneau d'hélices α hydrophobes orientées vers le centre du complexe toroïde (Seipin traps triacylglycerols to facilitate their nanoscale clustering in the endoplasmic reticulum membrane 2021 et Seipin accumulates and traps diacylglycerols and triglycerides in its ring-like structure 2021).
La conservation évolutive de plusieurs acides aminés polaires dans l'hélice centrale hydrophobe a conduit à l'hypothèse que cette région est capable :
- d'interagir avec une protéine membranaire,
- de se lier aux esters carboxyliques lipidiques.
Interactions avec LDAF1/prométhine
LDAF1 (LD assembly factor 1), appelée aussi prométhine ou TMEM159, Ldo45/16 chez la levure, se trouve dans le RE isolé dans certains domaines ou associé à la seipine (LDAF1 and Seipin Form a Lipid Droplet Assembly Complex 2019 et Promethin Is a Conserved Seipin Partner Protein 2019).
Lors du jeûne, la seipine ne s'associe pas à LDAF1, mais lorsque la synthèse de lipides neutres synthèse est initiée, la fraction de seipine associée à la prométhine augmente (Seipin traps triacylglycerols to facilitate their nanoscale clustering in the endoplasmic reticulum membrane 2021).
1. Deux sérines conservées dans l'hélice centrale sont nécessaires à l'interaction de la seipine avec LDAF1.
a. La seipine et LDAF1, forme un complexe stœchiométrique qui, contrairement à la seipine seule, contient des triglycérides (TG).
b. LDAF1 serait flexible et comparée à la micelle plate de la seipine purifiée seule, la micelle du complexe seipine/LDAF1/TG est courbée sur le côté faisant face au cytosol, représentant peut-être un intermédiaire précoce dans la formation des gouttelettes lipidiques (LD).
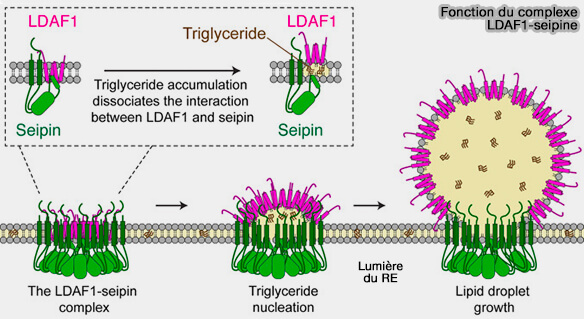
(Figure : vetopsy.fr d'après Chung et coll)
2. L'homologue de LDAF1 est Ldo45 (Lipid droplet organization protein of 45 kDa) de la levure (Regulation of lipid droplets by metabolically controlled Ldo isoforms 2018 et Identification of seipin-linked factors that act as determinants of a lipid droplet subpopulation 2018).
- Ldo45 semble moduler le stockage des triglycérides (TG) alors que Ldo16, son isoforme, n'affecte pas le protéome LD et fonctionne principalement en cas d'épuisement des nutriments, facilitant ainsi la consommation des LD par lipophagie.
- Un article récent a montré que Ldo16/45 forme un complexe d'attache avec Vac8 pour la création de sites de contact de gouttelettes lipidiques avec les vacuoles (vCLIP, vaCuole LIPid droplet contact sites), l'équivalent des MCS LD-lysosomes, qui peuvent se former en l'absence de seipine (A metabolically controlled contact site between lipid droplets and vacuoles 2023).
Interactions avec les lipides neutres ?
Les domaines transmembranaires (TM) pourraient faciliter ce processus en se liant aux triglycérides (TG) comme proposé par certaines simulations moléculaires (Seipin concentrates distinct neutral lipids via interactions with their acyl chain carboxyl esters 2022).
1. Les deux même sérines conservées, i.e. Ser165/Ser166 dans l'hélice α3 de la seipine humaine, formeraient des liaisons hydrogène avec les groupes glycérol des triglycérides (TG), facilitant la formation de lentilles lipidiques (Seipin traps triacylglycerols to facilitate their nanoscale clustering in the endoplasmic reticulum membrane 2021).
- Ces sérines interagissent également avec les esters de cholestérol (CE) dans des simulations, ce qui pourrait montrer un mécanisme applicable pour la formation initiale des LD (Seipin accumulates and traps diacylglycerols and triglycerides in its ring-like structure 2021).
- Cela pourrait être une des explications de la séparation de LDFA1 de la seipine pendant l'accumulation des lipides (
modèle de la formation des LD).
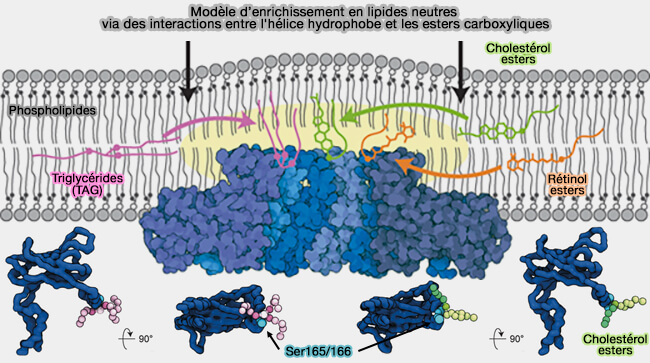
et les esters carboxyliques
(Figure : vetopsy.fr d'après Renne et coll)
2. Contrairement à l'homme, la seipine de levure (Fld1/Sei1) nécessite une autre protéine RE, Ldb16, pour la fonction LDAC (LD Assembly protein Complexes) dans la biogenèse des LD (Mechanism of lipid droplet formation by the yeast Sei1/Ldb16 Seipin complex 2021).
- Le domaine luminal Sei1 ne contient pas d'hélice hydrophobe et donc la capacité de concentrer les triglycérides.
- Ldb16 possède une courte région hélicoïdale riche en résidus sérine et thréonine similaire aux hélices des seipines de l'homme et la mouche.
- Cette particularité de la levure en fait un système idéal pour disséquer les fonctions distinctes des protéines au sein des LDAC.
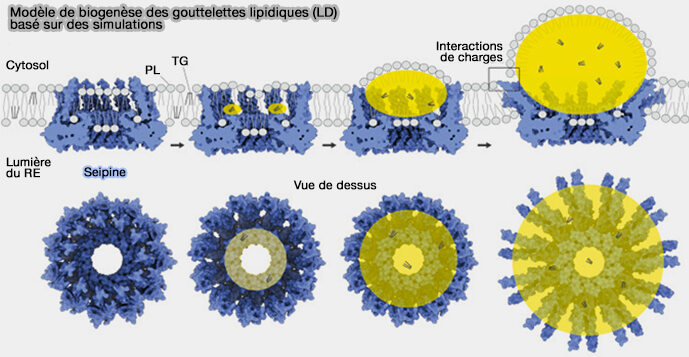
(Figure : vetopsy.fr d'après Whalter et coll)
Domaines transmembranaires
Chez la levure, les domaines transmembranaires peuvent changer de conformation, i.e. conformations A et B, grâce aux régions de commutation (Seipin forms a flexible cage at lipid droplet formation sites 2022).
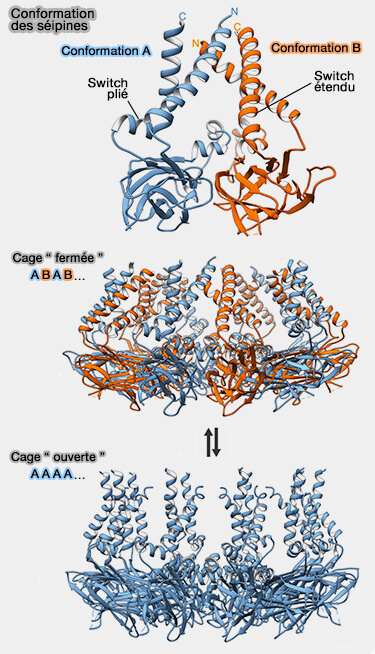
(Figure : vetopsy.fr d'après Whalter et coll)
1. Les régions de commutation (switch) connectent les domaines luminaux aux domaines TM inclinés vers le centre de la structure en anneau sous-jacente.
La conformation A est pliée et la conformation B est plus étendue.
2. La commutation entre différentes conformations des segments TM entraîne la formation d'une structure en cage :
- plus fermée, i.e. conformations A et B alternées,
- ouverte, i.e. toutes les sous-unités en conformation A, suggérant que le dôme de la cage pourrait être capable de s'ouvrir vers le cytoplasme.
Extrémités
Les régions N- et C-terminales de la seipine de chaque côté de la membrane du réticulum endoplasmique (RE) sont moins conservées au cours de l'évolution (Structure and function of lipid droplet assembly complexes 2023)
a. Chez l'homme, les régions N- et C-terminales semblent indispensables pour fonctionner dans la formation des LD (Seipin transmembrane segments critically function in triglyceride nucleation and lipid droplet budding from the membrane 2022).
Elles semblent ancrer le LDAC à la membrane du réticulum endoplasmique (RE) lors de la formation des LD (
b. Chez la mouche, la partie cytoplasmique N-terminale de la protéine est plus longue et suffisante à elle seule pour lier les LD et chez la levure, l’extrémité N cytosolique de 10 acides aminés n’est pas nécessaire à la fonction seipine.
Partenaires de la seipine
Les partenaires de la seipine sont loin d'être tous identifiés et d'autres partenaires que LDAF1/Lod45/16 interagissant avec elle seraient également impliqués dans le métabolisme lipidique.

Les autres partenaires de la seipine sont étudiés dans un chapitre spécifique.
Modèle hypothétique de formation des LD au RE
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


