Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Lipolyse : HSL et MGL/MGAL
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

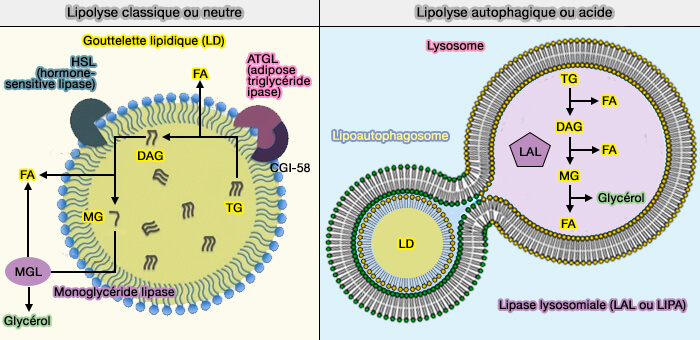
HSL (Hormone-Sensitive Lipase) et MGL/MGAL (MonoacylGlycérol Lipase) sont impliquées dans la lipolyse des gouttelettes lipidiques (LD).
La lipolyse des LD fait intervenir d'autres lipases qui sont toutes étudiées dans des chapitres spécifiques :
- L'ATGL (Adipose TriGlycéride Lipase) appelée aussi PNPLA2 (PatatiN-like PhosphoLipAse domain-containing protein 2) qui catalyse la première réaction lipolytique dans les LD, i.e. dégradation des triglycérides (TG) en diglycérides (DAG),
- LAL (Lipase lysosomale ou LIPA), enzyme qui catalyse les trois réaction précédentes dans les lysosomes lors de lipophagie.
Remarque : la lipolyse intervient aussi sur les lipoprotéines sanguines.
(Figure : vetopsy.fr)

Vous pouvez lire : Lipolysis: cellular mechanisms for lipid mobilization from fat stores (2021) qui décrit bien les lipases et leur régulation.
HSL (Hormone-Sensitive lipase)
Structure et fonctions
1. HSL (Hormone-Sensitive lipase), lipase dite neutre, est une hydrolase à sérine (EC 3.1.1.79), à appartenant à la famille des plis ou repliements α/β-hydrolase.
HSL hydrolyse un grand nombre de substrat avec une activité plus élevée contre les diglycérides (DAG) et les esters de cholestérol (CE), puis les triglycérides (TG), les monoglycérides (MG), les esters de rétinyle et les esters d'acyle à chaîne courte.
$\ce{Diglycéride + H2O}$ $\leftrightharpoons$ $\ce{Monoglycéride + acide gras + H+}$
$\ce{Cholestéryl-esters + H2O}$ $\leftrightharpoons$ $\ce{Cholestérol + acide gras + H+}$
$\ce{Rétynyl-esters + H2O}$ $\leftrightharpoons$ $\ce{Rétinol + acide gras + H+}$

Vous pouvez lire : Hormone-sensitive lipase: sixty years later (2020) qui décrit toutes les fonctions de HSL
(Figure : vetopsy.fr d'après Li et coll)
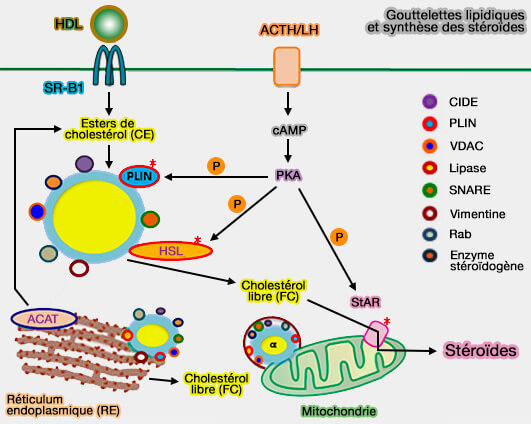
Remarque : HSL est la principale lipase de la glande surrénale et les esters de cholestérol (CE) des goutelettes lipidiques (LD ou Lipid Droplet), après absorption par SR-B1 des HDL (lipoprotéines de haute densité) sont ensuite hydrolysés pour la synthèse des stéroïdes.
(Figure : vetopsy.fr d'après Shen et coll)
Régulation par phosphorylation
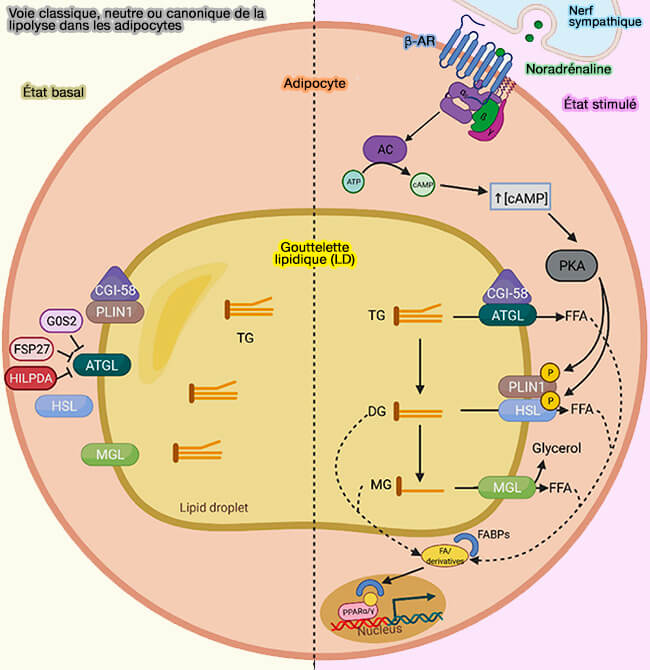
L'activité de la HSL est régulée par les hormones tropiques, d'où son nom, grâce en particulier à ses sites de phosphorylation, i.e. sur les sérines.
1. L'enzyme possède cinq sites de phosphorylation de la sérine qui sont ciblés par plusieurs kinases et qui ont une fonction régulatrice affectant l'activité enzymatique.
- Chez l'homme, Ser649 et Ser650 (659 et 660 chez la souris) sont les principaux sites de phosphorylation de la PKA contrôlant la translocation de l'HSL du cytosol vers la LD et l’activité enzymatique (Ser649 and Ser650 Are the Major Determinants of Protein Kinase A-Mediated Activation of Human Hormone-Sensitive Lipase against Lipid Substrates 2008).
- Ser424 catalytique est également nécessaire à la migration des LD car sa mutation empêche la translocation, i.e. la triade catalytique étant complétée par Asp-693 and His-723.
- Ser552 (563 chez la souris) phosphorylé par la PKA et Ser589 (600 chez la souris) par ERK ont un rôle plus obscur.
Remarque : PKG phosphoryle les mêmes sites que la PKA (Involvement of a cGMP-dependent Pathway in the Natriuretic Peptide-mediated Hormone-sensitive Lipase Phosphorylation in Human Adipocytes 2003).
1. Les hormones pro-lipolytiques comme les catécholamines ou les hormones stéroïdiennes comme l'ACTH par exemple, et anti-lipolytiques comme l'insuline contrôlent l'activité de HSL par la régulation du niveau intracellulaire d'AMPc (Lipolysis and lipid mobilization in human adipose tissue 2009).
La phosphorylation de HSL par PKA augmente sa translocation du cytosol vers la LD, provoque des changements de conformation qui expose la surface hydrophobe HSL pour sa liaison au substrat lipidique et l'hydrolyse lipidique (Phosphorylation of hormone-sensitive lipase by protein kinase A in vitro promotes an increase in its hydrophobic surface area 2009).
2. La déphosphorylation est moins bien connue par PP2A et PP2C.
PP2A migrerait vers le LD grâce à PRIP (Phospholipase C-Related catalytically inactive Protein) liée à la phospholipase C (Phospholipase C-Related Catalytically Inactive Protein (PRIP) Regulates Lipolysis in Adipose Tissue by Modulating the Phosphorylation of Hormone-Sensitive Lipase 2014).
Autres régulations
1. L'HSL peut former des homodimères qui améliorent l’efficacité hydrolytique de l’enzyme (Hormone-Sensitive Lipase Functions as an Oligomer 2000).
2. HSL interagit avec différentes protéines associées à la LD, notamment les périlipines (Plins).
- Plin1 est phosphorylé par PKA ou PKG, permettant l'interaction HSL/Plin1 grâce au domaine PAT, qui provoque la translocation de l'HSL à la surface des LD (Activation of Hormone-sensitive Lipase Requires Two Steps, Protein Phosphorylation and Binding to the PAT-1 Domain of Lipid Droplet Coat Proteins 2009).
- Une interaction avec la vimentine, la plus abondante des protéines des filaments intermédiaires, est également requise pour la translocation (Vimentin Is a Functional Partner of Hormone Sensitive Lipase And Facilitates Lipolysis 2010).

L’interaction Plin1/vimentine/HSL est donc une étape clé dans la modulation du processus lipolytique.
3. L'activation de HSL transforme les diglycérides (DAG) en acides gras (FA) et monoglycérides (MG), i.e. qui inhibent normalement son activité.
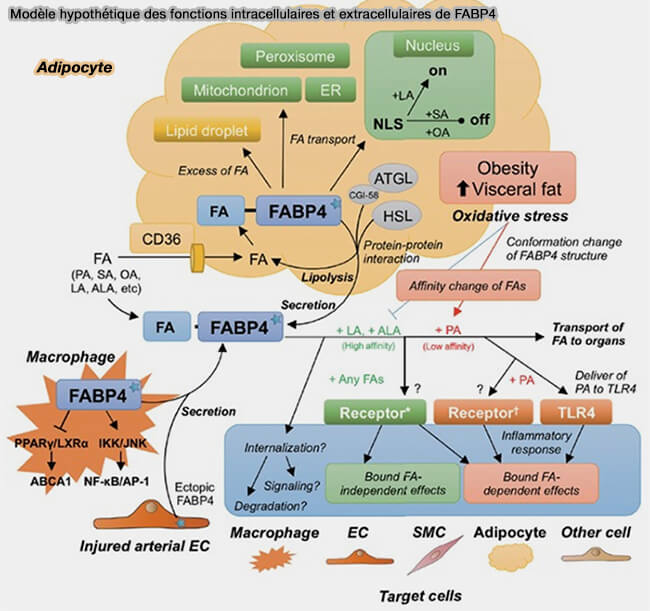
- Mais, les FA interagissent avec FABP4 qui les séquestrent (Fatty Acid-Binding Protein 4 in Cardiovascular and Metabolic Diseases 2019).
- L'activité hydrolytique de l'enzyme est donc augmentée.
(Figure : vetopsy.fr d'après Furuhashi)
Remarque : FABP4 comprendrait deux sites qui réguleraient la lipolyse :
- un site de liaison à la HSL (Mapping of the hormone-sensitive lipase binding site on the adipocyte fatty acid-binding protein (AFABP). Identification of the charge quartet on the AFABP/aP2 helix-turn-helix domain 2008),
- un site de liaison à CGI-58/ABHD5, le coactivateur de l'ATGL (Fatty Acid-binding Proteins Interact with Comparative Gene Identification-58 Linking Lipolysis with Lipid Ligand Shuttling 2015)

La combinaison de facteurs post-traductionnels et d'interactions protéine-protéine régulent donc l'activité de la HSL.
MGL/MAGL (monoacylglycérol lipase)
La MGL/MAGL (MonoacylGlycérol Lipase), EC 3.1.1.23 est une lipase cytosolique, HSL et MGL appartenant à la famille des plis ou repliements α/β-hydrolase.
MGL convertit principalement les monoglycérides (MG) sn-2 en acides gras (Monoglyceride lipase: structure and inhibitors 2016 et Crystal Structure of the Human Monoacylglycerol Lipase, a Key Actor in Endocannabinoid Signaling 2010).
$\ce{Monoglycéride + H2O}$ $\leftrightharpoons$ $\ce{Glycérol + acide gras + H}$
1. L'expression de MGL est soumise à une régulation nutritionnelle et dépendante de PPARα, mais pas à une modification post-traductionnelle (Comprehensive Analysis of PPARα-Dependent Regulation of Hepatic Lipid Metabolism by Expression Profiling 2007).
L'inhibition de la MGL, ciblée pour sa dégradation protéasomale par SND1 (Staphylococcal Nuclease and tudor Domain containing 1), pourrait provoquer des hépatocarcinomes (Staphylococcal nuclease and tudor domain containing 1 (SND1 protein) promotes hepatocarcinogenesis by inhibiting monoglyceride lipase (MGLL) 2016).
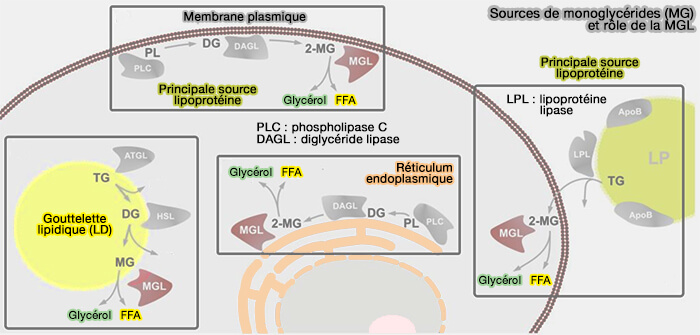
(Figure : vetopsy.fr d'après Grabner et coll)
Remarque : le monoglycéride (MG) le plus important agissant comme lipide de signalisation est le 2-arachidonylglycérol (2-AG), qui est l'agoniste endogène le plus abondant des récepteurs cannabinoïdes corporels (Monoglyceride lipase as a drug target: At the crossroads of arachidonic acid metabolism and endocannabinoid signaling 2017).
2. D'autres lipases peuvent hydrolyser les monoglycérides (MG), mais leur rôle est encore discuté, comme ABHD6 (α/β hydrolase containing-6) qui serait impliquée dans plusieurs processus pathologiques (Monoacylglycerol signalling and ABHD6 in health and disease 2017).
Retour vers la lipolyse adipocytaire
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


