Transport des lipides : lipoprotéines
Apolipoprotéines
ApoA-IV
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine A4 (apoA-IV), de la famille des apoA, est une apolipoprotéine impliquée dans la modulation de l'assemblage et du métabolisme des TRL (lipoprotéines riches en triglycérides).
Vue d'ensemble de l'apoA-IV
L'apoA-IV, appartenant à la famille des apolipoprotéines A1/A4/E, est codée par le le groupe de gènes APOA1/C3/A4/A5.
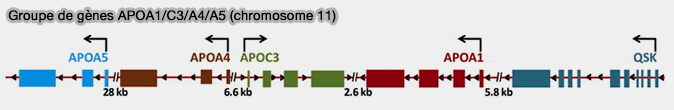
(Figure : vetopsy.fr d'après Halley et coll)
1. L'apoA-IV est exprimée :
- principalement dans l'intestin des mammifères, en particulier dans le jéjunum,
- dans l'hypothalamus et le tractus solitaire du tronc cérébral (Characterization of Apolipoprotein A-IV in Brain Areas Involved in Energy Homeostasis 2009),
- dans les cellules dendritiques du système immunitaire (Analysis of genes regulated by the transcription factor LUMAN identifies ApoA4 as a target gene in dendritic cells 2012).
Dans l'intestin grêle, l'apoA-IV est induite par l'absorption active des lipides.
2. L'apoA-IV est synthétisée dans les entérocytes et peut :
- soit être incorporée dans des chylomicrons naissants riches en triglycérides (TG) qui sont sécrétés dans la lymphe intestinale et finalement drainés dans la circulation par le canal thoracique (
sortie des chylomicrons),
- soit être sécrétée libre et former des préβ-HDL par le même processus que l'apoA-I (ApoA-IV promotes the biogenesis of apoA-IV-containing HDL particles with the participation of ABCA1 and LCAT 2013).
3. Au cours de l'hydrolyse ultérieure des TG par la LPL (LipoProtéine Lipase), la majeure partie de l'apoA-IV se dissocie des particules de chylomicrons par plusiuers mécanismes.
- L'augmentation de la pression de surface est due à la diminution rétrécissement du noyau suite à l'hydrolyse lipidique (
pression de surface).
-
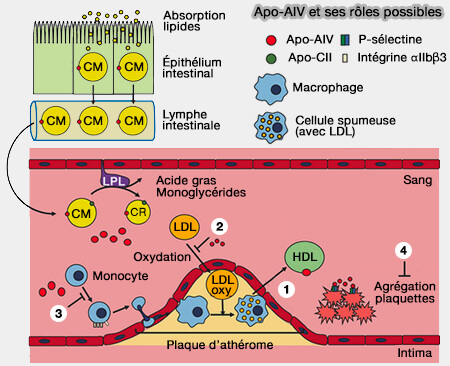
ApoA-IV et ses rôles possibles
(Figure : vetopsy.fr d'après Qu et coll) - Les apoE et apoC entrent en compétition pour la liaison des lipides.

25% de l'apoA-IV est transférée sur les HDL (lipoprotéines de haute densité) et les 75% restants existe sous forme libre dans le plasma (Plasma metabolism of apolipoprotein A-IV in humans 1988).
4. L'apoA-IV participe à un large éventail de processus biologiques (
Structure de l'apo-IV
L'apoA-IV mature est composée de 376 résidus d'acides aminés, qui, en l'absence de lipides, forme des homodimères.
Domaine central de l'apo-IV
Le domaine central est bien structuré et forment des hélices α amphipathiques qui contiennent des répétitions peptidiques de 22 acides aminés hautement conservées, en général des prolines (The Structure of Dimeric Apolipoprotein A-IV and Its Mechanism of Self-Association 2012).
1. Les hélices centrales (acides aminés 64–335) forment 4 hélices.
- L'hélice-B (96–204), la plus longue hélice forme une tige.
- L'hélice-A (74–94) N-terminale est perpendiculaire à l'hélice-B et coiffe une extrémité de la tige.
- L'hélice-C (206–255) et l'hélice-D (265–312), après un virage à 180° vers B, se replient en un bras hélicoïdal antiparallèle couvrant environ la moitié de la longueur de l'hélice B de l'autre extrémité de la tige.
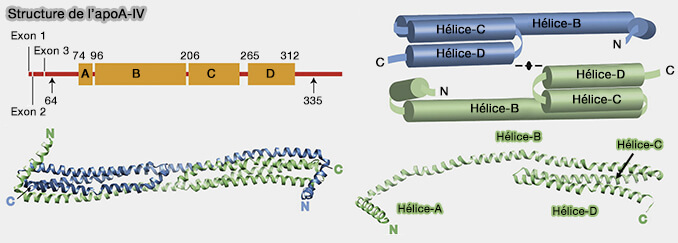
(Figure : vetopsy.fr d'après Deng et coll)
2. Cette orientation imbriquée permet l'enfouissement de la surface hydrophobe d'un monomère par l'autre à l'interface du dimère.
Extrémités de l'apoA-IV
Les extrémités N-terminales et C-terminales sont désordonnées (Modulation of Apolipoprotein A-IV Lipid Binding by an Interaction between the N and C Termini 2007).
1. Les extrémités N-terminales et C-terminales du monomère opposé confèrent une interaction intermoléculaire à une extrémité de la tige.
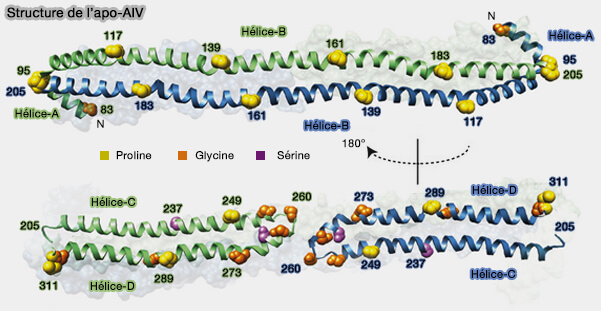
(Figure : vetopsy.fr d'après Deng et coll)
2. Elles jouent un rôle essentiel dans la manipulation de la capacité de liaison aux lipides de l'apoA-IV (Small-angle X-ray Scattering of Apolipoprotein A-IV Reveals the Importance of Its Termini for Structural Stability 2013).
Modèle de l'apoA-IV
Le modèle propose que le lipide soit initialement inséré dans la poche hydrophobe centrale du dimère.
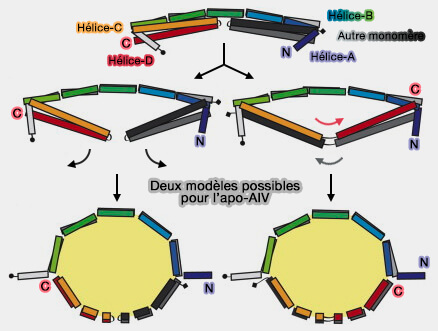
(Figure : vetopsy.fr d'après Deng et coll)
1. Au fur et à mesure que des lipides sont incorporés, les bras hélicoïdaux des hélices C et D se détendent et s'éloignent de la tige de l'hélice-B.
2. Elles forment un anneau circulaire pour faire prendre à la particule de lipoprotéine une forme de disque.
Remarque : dans la circulation, l'apoA-IV humaine a été détectée sous forme de glycoprotéine, qui contient 1,8 % de mannose, 1,55 % de galactose, 1,55 % de N-acétyl-D-glucosamine (GlcNAc) et 1,1 % d'acide sialique.
- L'apoA-IV serait O-glycosylée sans qu'on n'en connaisse pour l'instant les sites spécifiques (Combinatorial regulation of hepatic cytoplasmic signaling and nuclear transcriptional events by the OGT/REV-ERBα complex 2018).
- Le degré de glycation non enzymatique de l'apoA-IV circulante serait corrélé à la sévérité de la maladie coronarienne chez les patients diabétiques (Glycated Apolipoprotein A-IV Induces Atherogenesis in Patients With CAD in Type 2 Diabetes 2017).
Fonctions de l'apoA-IV dans le métabolisme des lipides
dans les voies d'absorption des lipides
L'apoA-IV joue un rôle dans la modulation de l'assemblage et du métabolisme des TRL (Triglyceride-Rich Lipoproteins), TRL qui englobent :
- les chylomicrons de la voie entéro-hépatique exogène ,
- les lipoprotéines de très basse densité (VLDL) de la voie d'apport (endogène).
Parmi les principales apolipoprotéines produites par le tractus gastro-intestinal (apoA-I, apoA-IV et apoB-48), l'apoA-IV est la plus sensible à l'ingestion de lipides.
Remarque : l'induction de la synthèse d'apoA-IV est médiée par l'absorption d'acides gras à longue chaîne, mais pas d'acides gras à chaîne courte (SCFA), qui sont transportés par la veine porte et ne provoquent pas la production de chylomicrons (Intestinal Synthesis and Lymphatic Secretion of Apolipoprotein A-IV Vary with Chain Length of Intestinally Infused Fatty Acids in Rats 1996).
1. Lors de l'alimentation lipidique, l'apoA-IV est assemblée en chylomicrons naissants dans les entérocytes intestinaux (Prechylomicron transport vesicle: isolation and partial characterization 1999).
- La surexpression de l'apoA-IV provoque une forte augmentation de la sécrétion de triglycérides (TG), d'esters de cholestérol et de phospholipides (PL) dans les particules de chylomicrons (Overexpression of Apolipoprotein A-IV Enhances Lipid Transport in Newborn Swine Intestinal Epithelial Cells 2002).
- L'apoA-IV augmente la sécrétion de TG de manière dose-dépendante, conduisant à la formation de chylomicrons plus gros riches en TG (Overexpression of Apolipoprotein A-IV Enhances Lipid Secretion in IPEC-1 Cells by Increasing Chylomicron Size 2006 et (Apolipoprotein A-IV regulates chylomicron metabolism–mechanism and function 2012).
- Les résidus 344 à 354 de l'apoA-IV humain sont essentiels pour sa capacité à favoriser la sécrétion de TG tandis que la région riche en EQQQ C-terminal jouait un rôle inhibiteur.
2. Les préchylomicrons, outre l'apoB-48, contiennent aussi de l'apoA-IV à leur surface, et sont transportées vers l'appareil de Golgi (

- La sous-expression de l'apoA-IV dans le réticulum endoplasmique (RE) des cellules d'hépatome de rat McA-RH7777 réduit le trafic d'apoB du réticulum endoplasmique (RE) vers l'appareil de Golgi, provoquant une diminution de la sécrétion d'apoB et de TG (apoA-IV modulates the secretory trafficking of apoB and the size of triglyceride-rich lipoproteins 2012)
- La surexpression de l'apoA-IV du rat a augmenté la sécrétion d'apoB, amélioré la croissance des particules contenant l'apoB et la sécrétion de TG (apoA-IV tagged with the ER retention signal KDEL perturbs the intracellular trafficking and secretion of apoB 2004).

L'apoA-IV interagit avec l'apoB dans la voie de sécrétion pour réguler la sécrétion des TRL (lipoprotéines riches en triglycérides).
L'apoA-IV serait un chaperon sécrétoire pour l'apoB et augmenterait le temps de séjour des lipoprotéines naissantes contenant l'apoB dans l'appareil de Golgi pour faciliter l'expansion du noyau des lipoprotéines avant la sécrétion.
3. L'apoA-IV favorise l'activité de la LPL (LipoProtéine Lipase) en présence de lipoprotéines contenant l'apoC-II (Lipoprotein ApoC-II activation of lipoprotein lipase. Modulation by apolipoprotein A-IV 1990).
L'activation de la LPL nécessite l'apoC-II, un composant de surface des chylomicrons, des VLDL (lipoprotéines de très basse densité) et des HDL (lipoprotéines de haute densité) (
Dans la voie de retour (reverse transport) du cholestérol
Le transport inverse du cholestérol (RCT ou Reverse cholesterol transport) implique une série d'événements entraînant le transport de l'excès de cholestérol des tissus périphériques vers le foie pour l'excrétion dans la bile et éventuellement les fèces.
L'apoA-IV et l'apoE peuvent former des HDL (lipoprotéines de haute densité) par le même processus que celui de l'apoA-I (

(Figure : vetopsy.fr d'après Qu et coll)
L'apoA-IV aurait un rôle anti-athérogène (Apolipoprotein A-IV: A Multifunctional Protein Involved in Protection against Atherosclerosis and Diabetes 2019)
1. L'apoA-IV est impliquée dans le transport inverse du cholestérol, probablement :
- en activant l'activité LCAT (Lécithine-Cholestérol AcylTransférase),
- en facilitant le transport du cholestérol des cellules spumeuses (foam cell en anglais) ou d'autres cellules périphériques vers les HDL.
2. Elle peut réduire la production des oxLDL (lipoprotéines de basse densité (oxydées) qui sont constamment absorbées par les macrophages pour former des cellules spumeuses.
3. L'apoA-IV a un rôle d'anti-inflammatoire probablement en supprimant l'adhésion des leucocytes et des plaquettes médiée par la sélectine P aux cellules endothéliales.
4. Ses récepteurs sont :
- l'intégrine αIIbβ3, i.e. elle inhibe l'agrégation plaquettaire,
- LRP1 (LDL Receptor–Related Protein-1) dans les adipocytes (Low-density lipoprotein receptor-related protein 1 (LRP1) is a novel receptor for apolipoprotein A4 (APOA4) in adipose tissue 2021).
Autres fonctions de l'apoA-IV

Pour les autres fonctions de l'apoA-IV, reportez-vous à : Apolipoprotein A-IV: A Multifunctional Protein Involved in Protection against Atherosclerosis and Diabetes (2019).
L'apoA-IV peut intervenir dans :
- l'agrégation plaquettaire et la thrombose (Apolipoprotein A-IV binds αIIbβ3 integrin and inhibits thrombosis 2018 et Reversible Platelet Integrin αIIbβ3 Activation and Thrombus Instability 2022),
- l'hémostasie du glucose (Apolipoprotein A-IV improves glucose homeostasis by enhancing insulin secretion 2012 et ApoA-IV improves insulin sensitivity and glucose uptake in mouse adipocytes via PI3K-Akt Signaling 2017),
- la prise alimentaire (Apolipoprotein A-IV exerts its anorectic action through a PI3K/Akt signaling pathway in the hypothalamus 2018).
Retour aux apolipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


