Transport des lipides
Lipoprotéines : récepteurs
Récepteurs LDLR : LRP1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

LRP1 (LDL Receptor–Related Protein-1) est un membre de la famille des LDLR (Low-Density Lipoprotein Receptor) impliqué dans l'endocytose et dans la signalisation intracellulaire, qui joue un rôle dans de nombreux processus cellulaires et biologiques.
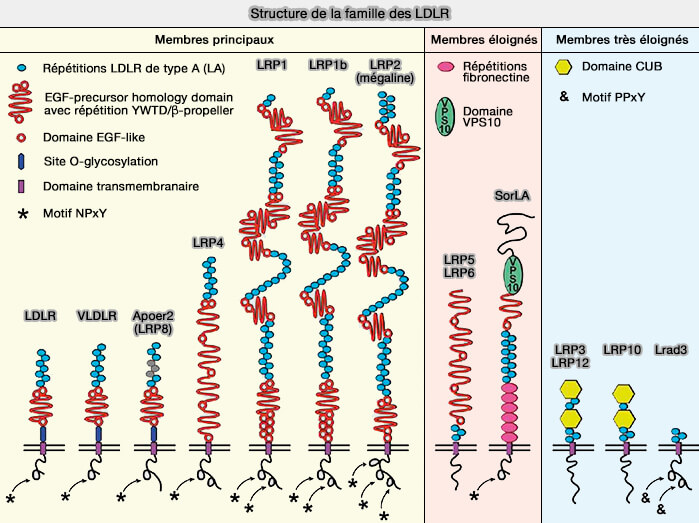
(Figure : vetopsy.fr d'après Pohlkamp et coll)
LRP1 (LDL Receptor–Related Protein-1) est un récepteur ubiquitaire, exprimé abondmment dans le foie et le cerveau.
Structure de LRP1 (LDL Receptor–Related Protein-1)
LRP1 (LDL Receptor–Related Protein-1), appelé aussi A2MR (Alpha-2-Macroglobulin Receptor), APOER (APOpolipoprotein E Receptor) ou CD91 (Cluster of Differentiation 91), est, avec LRP2, les plus grands LDLR (LDL Receptor–Related Protein-1: A Regulator of Inflammation in Atherosclerosis, Cancer, and Injury to the Nervous System 2014).
- La protéine précurseur LRP1, synthétisée dans le réticulum endoplasmique (RE) et liée à une protéine chaperonne RAP (Receptor Associated Protein) ou LRPA1, est transportée vers le réseau trans-Golgi (TGN) où le faible pH provoque la dissociation de RAP.
- La furine (EC 3.4.21.75) clive le précurseur LRP1 au niveau de la séquence consensus Rx(K/R)R pour générer une grande chaîne α et une chaîne β plus petite qui sont liées de manière non covalente et acheminées vers la membrane cellulaire, où elles sont intégrés comme une seule unité fonctionnelle.
1. Sa structure comportant quatre LBD (Ligand Binding Domain) en fait l'un des LDLR le plus polyvalent car il peut se lier se lier à plus de 100 ligands différents, i.e (
-
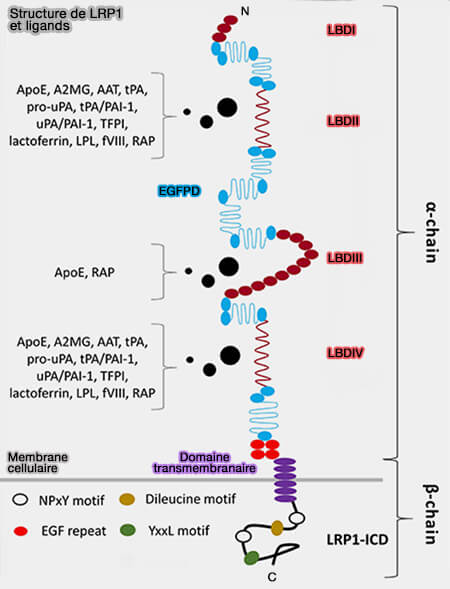
Structure de LRP1 et ligands
(Figure : vetopsy.fr d'après Potere et coll) - aux protéases et à leurs complexes inhibiteurs,
- aux facteurs de croissance,
- à d'autres protéines impliquées dans le métabolisme des lipoprotéines.
Les LBD II et IV se lient à la majorité des ligands, ses LBD (I-IV) contiennent respectivement 2, 8 10 et 11 cystéines.
2. Les EGFPD (Epidermal Growth Factor-Precursor homology Domain) dissocient du complexe ligand-récepteur s'effectue au niveau endosomal (
3. Le domaine cytoplasmique est long, i.e. une centaine de résidus, contient plusieurs motifs particuliers.
a. Les motifs YxxL et dileucine servant de ciblage des récepteurs dans les fosses rrcouvertes de clathrine, contrairement aux autres récepteurs de lipoprotéine (Beyond endocytosis: LRP function in cell migration, proliferation and vascular permeability 2005).
b. Les deux motifs NPxY fonctionnent comme des signaux secondaires d'endocytose et de sites d'amarrage pour les protéines adaptatrices cytoplasmiques comme Disabled-1 (Dab1), la protéine kinase α (PKCα), SHC et FE65, qui interviennent dans la transduction du signal dépendant de LRP1 (
- LRP1 initie la signalisation par liaison directe au ligand ou par l'intermédiaire de ses corécepteurs.
- La phosphorylation de la tyrosine au niveau des motifs NPxY est nécessaire pour la transduction du signal.
Protéolyse de LRP1
Des enzymes protéolytiques agissent sur LRP1, mais aussi sur l'APP (Amyloid-beta Precursor Protein) de la maladie d'Alzheimer (Functional Roles of the Interaction of APP and Lipoprotein Receptors 2017).
1. Plusieurs sheddases, i. e. enzymes liées à la membrane qui clivent les parties extracellulaires des protéines transmembranaires, libérant les ectodomaines (ECD) solubles de la surface cellulaire, ont été impliquées dans le clivage protéolytique de LRP1e (The generation and function of soluble apoE receptors in the CNS 2006).
-
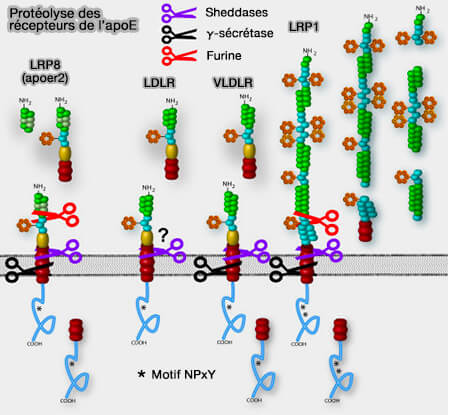
Protéolyse de certains récepteurs LDLR de l'apoE
(Figure : vetopsy.fr d'après Rebeck et coll)
a. Les ADAM (A Disintegrin And Metalloproteinase) sont une famille de transmembranaires à passage unique comme :
- ADAM10 (Inhibition of ADAM10 promotes the clearance of Aβ across the BBB by reducing LRP1 ectodomain shedding 2016),
- ADAM12 et MT1-MMP (Cell cholesterol modulates metalloproteinase-dependent shedding of low-density lipoprotein receptor-related protein-1 (LRP-1) and clearance function 2011)
- ADAM17 (LRP1 shedding in human brain: roles of ADAM10 and ADAM17 2009),
b. β-sécrétase 1 ou BACE1 (Beta-site Amyloid precursor protein Cleaving Enzyme 1) est une protéase importante :
- dans la production accrue du peptide bêta-amyloïde (Aβ) par le clivage de l'APP (Amyloid-beta Precursor Protein), dans la maladie d'Alzheimer,
- dans la formation des gaines de myéline dans les cellules nerveuses périphériques (The Low Density Lipoprotein Receptor-related Protein (LRP) Is a Novel β-Secretase (BACE1) Substrate 2005 et Endosomal sorting and trafficking, the retromer complex and neurodegeneration 2019).
Le recyclage de BACE1 est perturbé par la diminution des taux de la nexine SNX4.
c. La γ-sécrétase est une endopeptidase qui hydrolyse le domaine intracellulaire ou ICD (LDL Receptor-Related Proteins in Neurodevelopment 2003).
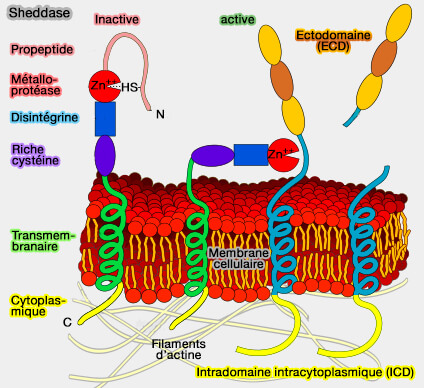
(Figure : vetopsy.fr d'après Kuebi)
2. Le traitement séquentiel de LRP1 produit d'abord un LRP1-ECD soluble, suivi d'une libération médiée par la γ-sécrétase du LRP1-ICD, i.e. domaine intracytoplasmique (Proteolytic Processing of Low Density Lipoprotein Receptor-related Protein Mediates Regulated Release of Its Intracellular Domain 2002).
- Le LRP1-ECD est capable de se lier aux ligands LRP1 et d'inhiber leur clairance (LRP-1: A Checkpoint for the Extracellular Matrix Proteolysis 2013),
- Le LRP1-ICD peut se transloquer vers le noyau et réguler la transcription des gènes.
Cette régulation transcriptionnelle médiée par LRP1-ICD pourrait jouer un rôle dans la neuroinflammation qui apparaît comme un facteur commun à de nombreuses neuropathologies comme la maladie d'Alzheimer (Neuroinflammation in Alzheimer's Disease 2015 et Role of neuroinflammation in neurodegenerative diseases (Review) 2016).
Fonctions de LPR1
Vue d'ensemble

LRP1 joue un rôle clef dans la signalisation intracellulaire et l'endocytose, ce qui l'implique dans de nombreux processus cellulaires et biologiques.
LRP1 contribue principalement à réguler l'activité des protéines en se liant à des protéines cibles en tant que corécepteur, en conjonction avec des protéines membranaires intégrales ou des protéines adaptatrices.
L'importance du rôle de LRP1 est démontrée par son KO qui provoque la mort embryonnaire à un stade précoce de développement en modulant la prolifération, la survie et la différenciation des cellules souches gliales radiales (Low-density lipoprotein receptor-related protein 1 (LRP1) is a novel modulator of radial glia stem cell proliferation, survival and differentiation 2016 et Low Density Lipoprotein Receptor Related Proteins as Regulators of Neural Stem and Progenitor Cell Function 2016).
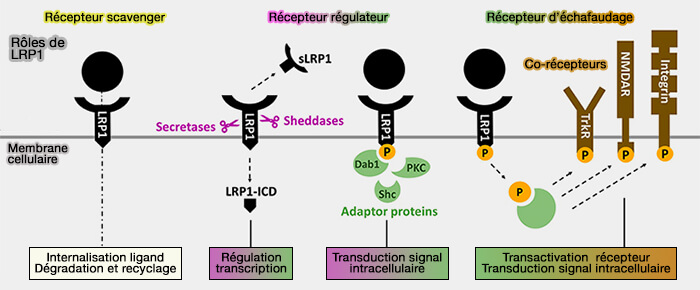
(Figure : vetopsy.fr d'après Potere et coll)
1. LRP1 est une protéine multifonctionnelle car il agit comme :
- récepteur scavenger en intériorisant une pléthore de ligands extracellulaires,
- récepteur régulateur en modulant la signalisation cellulaire en réponse à divers stimuli extracellulaires
- récepteur d'échafaudage en ayant la capacité de s'associer et de moduler l'activité d'autres protéines membranaires telles que les intégrines et les récepteurs tyrosine kinases.
2. La fonction endocytaire et les propriétés de signalisation confèrent un rôle majeur à LRP1 dans :
- le métabolisme des lipides et des lipoprotéines,
- la dégradation des protéases,
- la régulation des récepteurs du facteur de croissance dérivé des plaquettes,
- la maturation et le recyclage des intégrines,
- la régulation du tonus vasculaire,
- la régulation de la la perméabilité de la barrière hémato-encéphalique,
- la croissance cellulaire,
- la migration cellulaire (
explication dans le chapitre sur LRP1B),
- l'inflammation,
- l'apoptose.
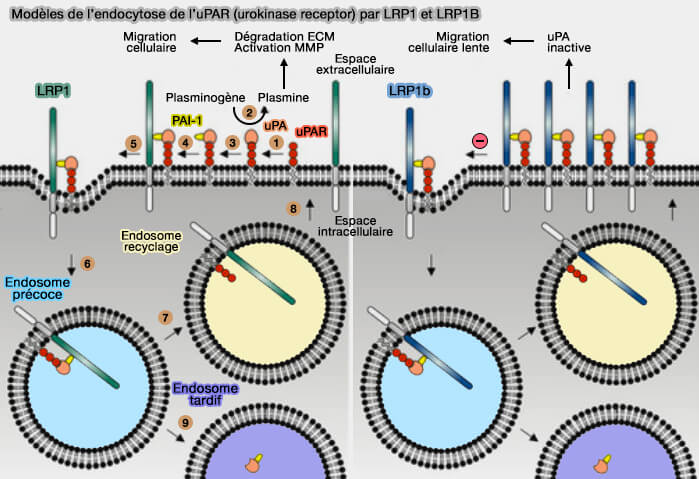
(Figure : vetopsy.fr d'après Principe et coll)

Vous pouvez lire le mécanisme moléculaire détaillé dans : The molecular mechanism of LRP1 in physiological vascular homeostasis and signal transduction pathways (2021).
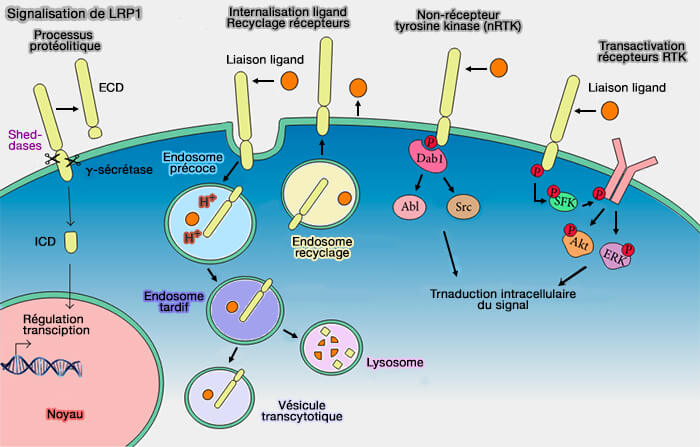
(Figure : vetopsy.fr d'après Auderset et coll)
3. Par ses différents processus, LRP1 est impliqué dans la physiopathologie de nombreuses maladies, entre autres :
- la stéatose hépatique,
- la fibrose rénale,
- le syndrome de détresse respiratoire aiguë (SDRA),
- l'athérosclérose, en inhibe la migration cellulaire des cellules musculaires lisses vasculaires et en régulant les récepteurs PDGF dans la paroi vasculaire (LDL Receptor–Related Protein-1: A Regulator of Inflammation in Atherosclerosis, Cancer, and Injury to the Nervous System 2014),
- l'infarctus du myocarde, les lésions d'ischémie-reperfusion (IRI, i.e. exacerbation paradoxale du dysfonctionnement cellulaire provoquant sa mort, suite à la restauration du flux sanguin vers des tissus précédemment ischémiques ou le remodelage ventriculaire gauche (Low Density Lipoprotein Receptor-Related Protein-1 in Cardiac Inflammation and Infarct Healing 2019),
- le cancer,
- la maladie d'Alzheimer (
explication dans le chapitre sur LRP1B).
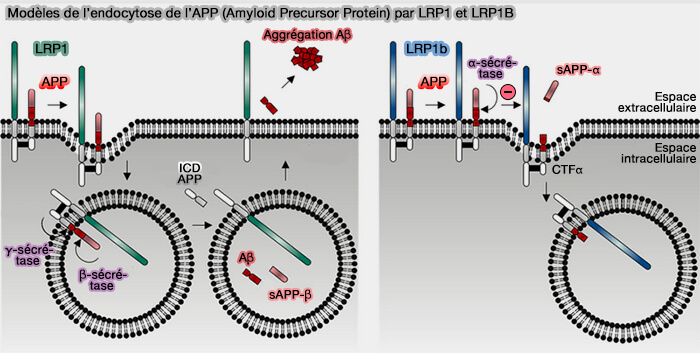
(Figure : vetopsy.fr d'après Principe et coll)

Nous ne pouvons pas détailler tous les rôles de LRP1 et vous pouvez trouvez sur le net des articles correspondants aux sujets qui vous intéressent !
LRP1 et métabolisme lipidique
Dans le métabolisme lipidique, LRP1 interagit, en particulier, sur l'apoE et intervient donc sur les nombreuses fonctions de cette apolipoprotéine (
LRP1 permet l'absorption des remnants par le foie (LDL Receptor-Related Protein 1: Unique Tissue-Specific Functions Revealed by Selective Gene Knockout Studies 2008).
- Outre l'homéostasie du cholestérol, LRP1 est impliqué dans l'absorption des acides gras.
- Les fibroblastes Lrp1-/- diminuent l'absorption des acides gras, entraînant une augmentation des acides gras libres et une redistribution vers le foie (LRP1 Controls Intracellular Cholesterol Storage and Fatty Acid Synthesis through Modulation of Wnt Signaling 2009).
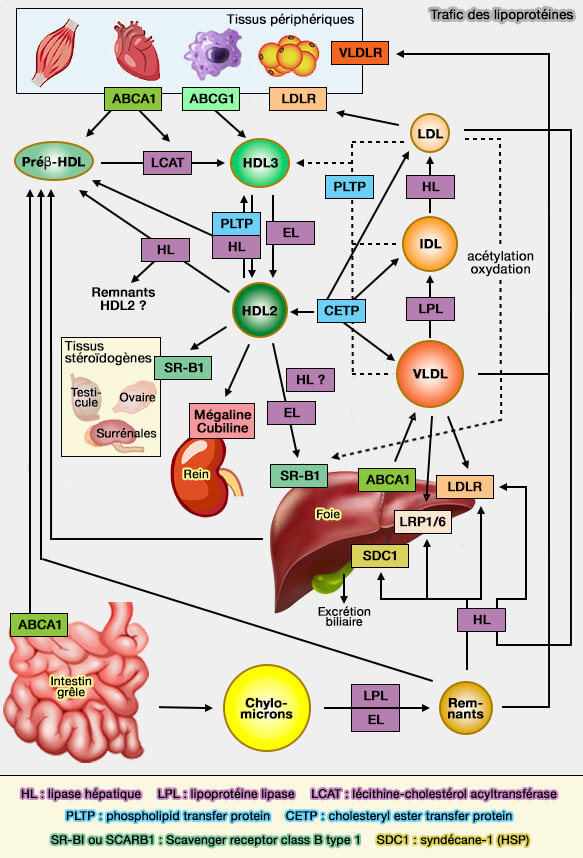
(Figure : vetopsy.fr)
Retour aux LDLR
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


