Transport des lipides : lipoprotéines
Apolipoprotéines
ApoA-1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine A1 (apoA-1), de la famille des apoA, constitue 70 % des apolipoprotéines des HDL (lipoprotéines de haute densité) et est essentielle à leur assemblage.
Vue d'ensemble de l'apoA-I
1. Environ 75 % de l'apoA-I est produite dans le réticulum endoplasmique (RE) :
- des hépatocytes pour 75 %,
- des entérocytes de l'intestin grêle pour les 25 % restants.
a. L'apoA-I est principalement catabolisée dans le foie.
b. L'apoA-I non associée aux lipides peut être filtrée dans les glomérules rénaux, reconnue par la cubiline, une protéine synthétisée par les cellules tubulaires rénales distales, internalisée et dégradée par les cellules épithéliales rénales (
(Figure : vetopsy.fr)
2. L'apoA-I est la seule apolipoprotéine à traverser la barrière hémato-encéphalique (Intravenously Injected Human Apolipoprotein A‐I Rapidly Enters the Central Nervous System via the Choroid Plexus 2014).
- Elle est avec l'apoE les apolipoprotéines les plus abondantes dans le liquide céphalo-rachidien (LCR), respectivement environ 0,37 mg/dl et 0,30 mg/dl.
- Le transport de l'apoA-1 ne dépend pas de la clathrine, i.e. il est est cholestérol-dépendant et est inhibé par la nystatine (Apolipoprotein A-I Crosses the Blood-Brain Barrier through Clathrin-Independent and Cholesterol-Mediated Endocytosis 2019).
3. L'apoA-1 constitue 70 % des apolipoprotéines des HDL (lipoprotéines de haute densité), structures hétérogènes et dynamiques échangeant des lipides avec des cellules et d'autres lipoprotéines.
L'apoA-I est aussi présente dans les chylomicrons (CM).
- Elle est transportée du RE au Golgi dans les vésicules COPII, mais par une voie distincte de celle du préchylomicron, i.e. elle sera incorporée dans les préchylomicrons qu'après fusion des PCTV avec l'appareil de Golgi
- Au cours du catabolisme des chylomicrons par la LPL (LipoProtéine Lipase), l'apoA-I se sépare de la surface du résidu conduisant à la formation de HDL lors de l'ajout de phospholipides.
Structure de l'apoA-I
L'apoA-I, appartenant à la famille des apolipoprotéines A1/A4/E, est codée par le groupe de gènes APOA1/C3/A4/A5.
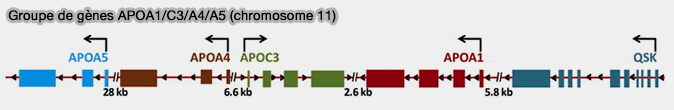
(Figure : vetopsy.fr d'après Halley et coll)
L'apoA-1 est un polypeptide de 243 acides aminés (A Consensus Model of Human Apolipoprotein A-I in its Monomeric and Lipid-free State 2017).
1. APOA1 contient deux domaines (A thumbwheel mechanism for APOA1 activation of LCAT activity in HDL 2018).
a. Le domaine N-terminal est composé des résidus 1 à 43, codé par l'exon3.
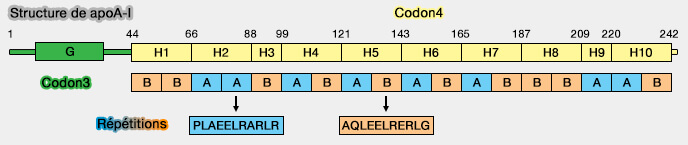
(Figure : vetopsy.fr d'après Mei et coll)
b. Le domaine C-terminal, résidus 44 à 243, codé par l'exon 4, comprend 10 répétitions alpha-hélicoïdales amphipathiques, fréquemment ponctuées par résidus de proline (Crystal structure of truncated human apolipoprotein A-I suggests a lipid-bound conformation 2007 et Crystal Structure of C-terminal Truncated Apolipoprotein A-I Reveals the Assembly of High Density Lipoprotein (HDL) by Dimerization 2011).
- huit 22-mers, i.e. répétitions AB ou BA,
- deux 11-mers, i.e. répétitions B, comme dans les périlipines (Plins) et les synucléines.
La partie C-terminale de l'apoA-I est importante pour la production de chylomicrons (CM).
(Figure : vetopsy.fr d'après Melchior et coll)
3. Selon les auteurs, apoA-I ne contiendrait pas ou bien comporterait des O-GalNAc glycanes à Thr-221 et Ser-228, mais leur composition reste inconnue (The known unknowns of apolipoprotein glycosylation in health and disease 2022).
Adaptation de l'apoA-I au remodelage des HDL
ApoA-1 dans les HDL naissantes
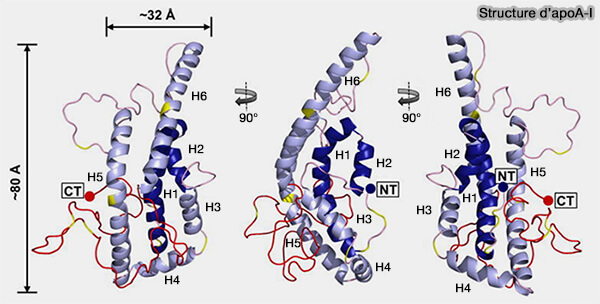
Dans les particules HDL discoïdes naissantes, deux molécules d'apoA-1 forment des anneaux anti-parallèles empilés autour de la circonférence de ces disques dans un agencement connu sous le nom de modèle à double ceinture (double belt model).
1. Les hélices 5 (en particulier G129) des deux molécules seraient directement opposées, i.e. cette conformation est appelée 5/5 (G129j) registry et ce modèle fait l'objet de de nombreuses variantes.
Ce modèle été confirmé récemment (Solution structure of discoidal high-density lipoprotein particles with a shortened apolipoprotein A-I 2017).
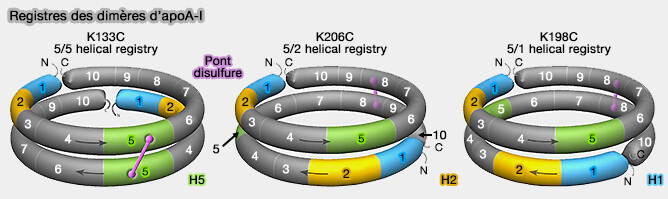
(Figure : vetopsy.fr d'après Cooke et coll)
2. Toutefois, il existe des petites quantité d'apoA-I à registres alternatifs 5/2 ou 5/1 ainsi que d'autres variations.
Adaptation des apoA-I à l'augmentation de taille des HDL

Un modèle structurel est expliqué dans : Structural stability and functional remodeling of high-density lipoproteins (2015).
1. Le modèle est basé sur les principes suivants.
- Les HDL subissent des réarrangements structurels minimaux à chaque étape du remodelage métabolique afin de minimiser les barrières cinétiques modulant ces étapes.
- De tels arrangements impliquent des changements conformationnels facilités par les régions flexibles contenant la glycine (G), i.e. les charnières G56-P66 et G184-G185, le tour contenant G39 et la répétition 5 contenant G129.
- La fusion des HDL implique un allongement progressif de la double ceinture apoA-I, tandis que la rupture des HDL et la libération des lipides centraux impliquent une perturbation des contacts de fermeture de la ceinture entre les extrémités N et C qui forment probablement le maillon le plus faible de la ceinture (Crystal Structure of Δ(185–243)apoA-I Suggests a Mechanistic Framework for the Protein Adaptation to the Changing Lipid Load in Good Cholesterol: From Flatland to Sphereland via Double Belt, Belt-Buckle, Double Hairpin and Trefoil/Tetrafoil 2013).
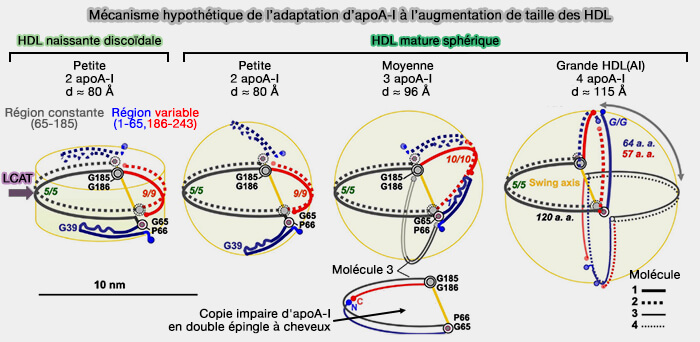
(Figure : vetopsy.fr d'après Gursky)
2. Pour allonger la ceinture, le faisceau d'hélices N-terminal pourrait s'ouvrir autour des deux charnières flexibles contenant G39 et G65–P66 (Crystal Structure of C-terminal Truncated Apolipoprotein A-I Reveals the Assembly of High Density Lipoprotein (HDL) by Dimerization 2011).
Pour fermer complètement la double ceinture, il doit y avoir un changement incrémentiel de la résistance des segments de fermeture de la ceinture près des extrémités moléculaires qui peut se faire grâce à un changement de registre des répétitions hélicoïdales, de 9/9 sur le petit, à 10/10 sur le moyen, à G/G sur le grand HDL, i.e. la répétition G englobe les résidus N-terminaux.
(Figure : vetopsy.fr d'après Gursky)
3. Un autre aspect important du mécanisme proposé est l'adaptation conformationnelle de l'apoA-I à la surface du HDL discoïde et sphérique.
Dans ce modèle, cette adaptation se produit via le mouvement de balancement de la double courroie autour de deux charnières, G65–P66 et G185–G186.
- Ces charnières divisent la molécule en deux moitiés d'environ 120 résidus, une région constante contenant les résidus centraux, i.e. 66–185, et une région variable contenant les résidus N-terminaux, i.e. 1-65, et C-terminaux, i.e. 185–243.
- Le mouvement de balancement des deux moitiés de la double ceinture fait passer le modèle d'une configuration d'une trèfle à 3 feuilles à un trèfle à 4 feuilles.
4. Ce modèle ne tient pas compte du modèle de " ceinture en boucle " dans lequel le segment apoA-I autour du résidu 140 adopte une conformation dynamique qui entre et sort du lipide (Apolipoprotein A-I Assumes a “Looped Belt” Conformation on Reconstituted High Density Lipoprotein 2006).
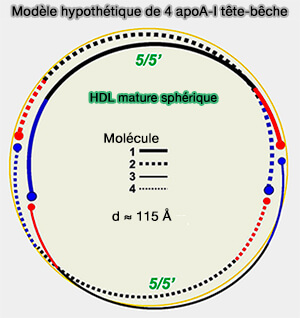
En outre, ce modèle pourrait s'adapter à d'autres stoechiométries HDL, y compris les HDL naissantes contenant trois, quatre copies ou plus d'apoA-I comme le montre la figure ci-contre montrant un modèle hypothétique d'une telle particule contenant quatre copies d'apoA-I organisées en deux dimères tête-bêche.
(Figure : vetopsy.fr d'après Kido et coll)
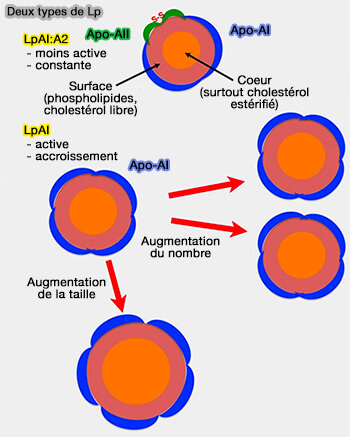
Remarque : l'apoA-II interviendrait aussi dans le remodelage des HDL (
On peut décrire des LpAI et des LpAI:AII.
- Les LpAI:AII contenant apoA-I et apoA-II, sont impliquées dans le transport des lipides, alors que les LpAI interviennent aussi dans bien d'autres processus (
autres fonctions de l'apoA-I).
L'apoA-II pourrait déplacer l'apoA-I des particules HDL, ce qui aurait pour effet de diminuer l'activité de la CETP (Cholesteryl ester (CE) Transfer Protein) et de la PLTP (Phospholipid transfer protein).
Fonctions de l'apoA-I
ApoA-1 et métabolisme des lipoprotéines
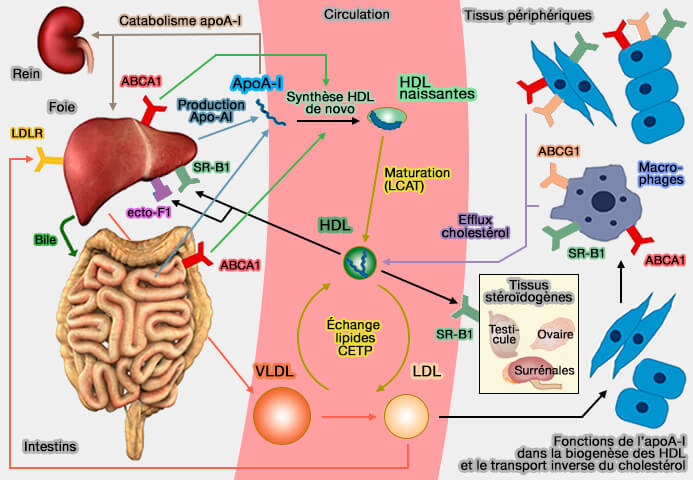
L'apoA-I est une apolipoprotéine des HDL (lipoprotéines de haute densité) qui intervient donc dans la voie RCT (transport inverse du cholestérol) ou voie de retour des lipides.
Les pré-β1-HDL correspondent à l'apoA-I pauvre en lipides (Characterization and properties of preβ-HDL particles formed by ABCA1-mediated cellular lipid efflux to apoA-I 2008).
1. L'ApoA-I est essentielle pour l'assemblage des HDL.
- Elle stabilise ABCA1, transporteur ABC, au niveau hépatique et intestinal, pour réguler l'efflux de phospholipides (PL) et de cholestérol libre vers des particules HDL discoïdes naissantes abritant deux à quatre molécules d'ApoA-I, conduisant à la biogenèse des particules HDL.
- Un efflux lipidique similaire par ABCA1 dans les cellules des tissus périphériques, i.e. directement dans diverses cellules, ou indirectement dans les macrophages (Mφ) des tissus périphériques initie le transport inverse du cholestérol (Specific Binding of ApoA-I, Enhanced Cholesterol Efflux, and Altered Plasma Membrane Morphology in Cells Expressing ABC1 2000).

(Figure : vetopsy.fr)
2. L'ApoA-I est un modulateur de LCAT (Lécithine-Cholestérol AcylTransférase) pour la production d'esters de cholestérol, conduisant à la maturation des HDL (A thumbwheel mechanism for APOA1 activation of LCAT activity in HDL[S] 2018).
- Les HDL subissent un remodelage supplémentaire par interaction avec la CETP (Cholesteryl Ester (CE) Transfer Protein) qui transfère les esters de cholestérol aux VLDL (lipoprotéines de très basse densité) et aux LDL (llipoprotéines de basse densité).
- La PLTP (PhosphoLipid Transfer Protein) transfère les phospholipides (PL) des VLDL aux HDL, conduit à la maturation et le remodelage des particules HDL.
3. L'ApoA-I lipidée des particules HDL discoïdes ou plus matures interagit avec un autre transporteur de la famille ABC, ABCG1 qui contribue davantage au transport RCT (
La liaison des particules HDL au SR-BI, exprimé dans les hépatocytes, transfère les esters de cholestérol et d'autres lipides, de sorte que l'excès de cholestérol peut être accepté par le foie, catabolisé et excrété via la bile vers l'intestin.
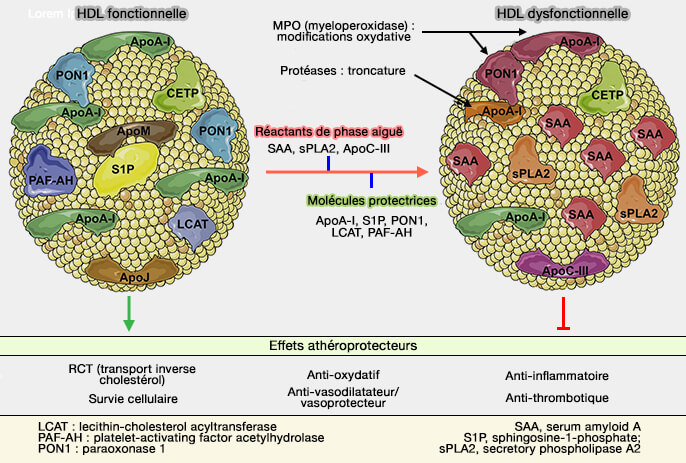
(Figure : vetopsy.fr d'après Soppert et coll)
4. La liaison des HDL au récepteur SR-BI ou SCARB1 (SCAvenger Receptor class B1), exprimé dans les hépatocytes, transfère les esters de cholestérol (CE) et d'autres lipides au foie.
- En conséquence, le cholestérol mobilisé au niveau des tissus périphériques peut pénétrer dans le foie et est catabolisé et excrété dans la bile.
- L'apoA-I elle-même est principalement catabolisée dans le foie.
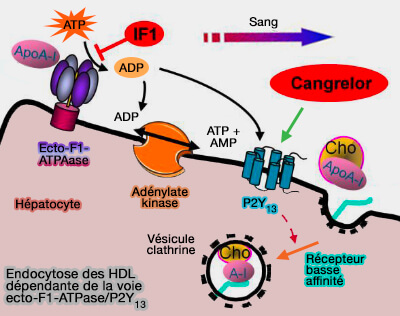
(Figure : vetopsy.fr d'après Cardouat)
5. En outre, la liaison des remnants HDL, produits après l'action de la LPL (LipoProtéine Lipase), ou les apoA-I pauvre en lipides, lient leur apoA-I à la sous-unité β de l'ecto-F1-ATPase.

Elle favorise l'internalisation cellulaire de la particule HDL entière liées au SR-BI (
Autres fonctions
1. L'apoA-I a d'autres fonctions.
- Elle inhibe l'apoptose et les processus prooxydatifs et proinflammatoires dans les cellules endothéliales.
- Elle induit une vasodilatation, inhibe l'activation des plaquettes et contribue à l'immunité innée.
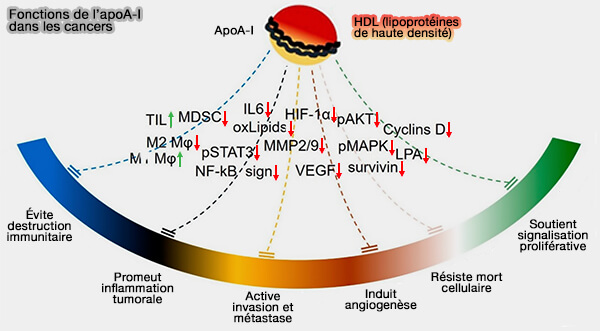
(Figure : vetopsy.fr d'après Georgila et coll)
2. L'apoA-I a une fonction athéroprotectrice et ses taux plasmatiques sont un facteur prédictif (Apolipoprotein A-I (ApoA-I), Immunity, Inflammation and Cancer 2019) :
- d'atteinte myocardique. d'infarctus, de maladies cardiovasculaires (MCV),
- d'inflammation,
- de cancer.
Retour aux apolipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


