Modifications post-traductionnelles des protéines
Ubiquitination : E3 ubiquitine ligases de la famille HECT
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

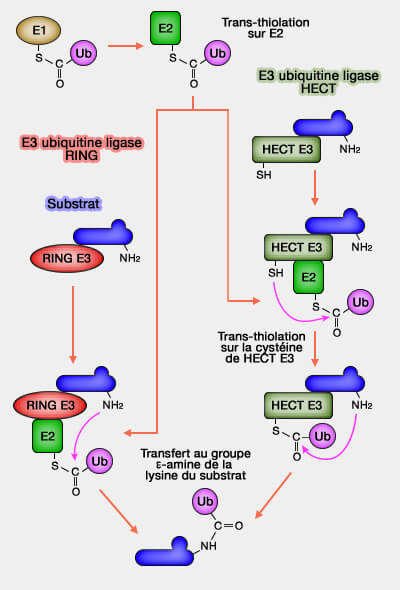
La famille HECT des E3 ubiquitine ligases catalyse l’ubiquitination en deux étapes, via une cystéine active, et se divise en trois sous-familles majeures.
Les E3 ubiquitine ligases sont classées en trois grandes familles (New insights into ubiquitin E3 ligase mechanism 2014 et HECT and RING finger families of E3 ubiquitin ligases at a glance 2012).
- la famille HECT,
- la famille RING, à domaine RING ou RING-related, les U-box ne contenant pas d'atomes de zinc y sont intégrées,
- la famille des RBR (RING-Between-RING).
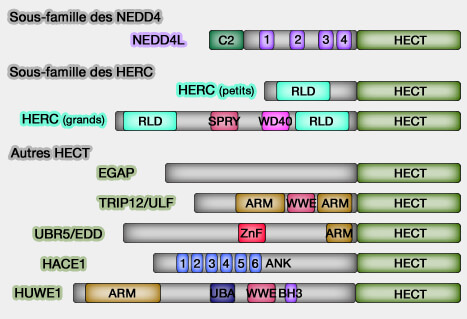
Membres de la famille HECT
(Figure : vetopsy.fr)
La famille HECT (Homology to E6AP C Terminus), une trentaine de membres chez les mammifères, se distingue par son mécanisme catalytique en deux étapes, formant un intermédiaire thioester entre la ligase et l’ubiquitine avant le transfert au substrat.
Elle est subdivisée en trois sous-familles, selon la présence de domaines caractéristiques situés dans leur extrémité N- ou C-terminale :
- la sous-famille NEDD4/NEDD4-like, à domaines WW,
- la sous-famille HERC (HECT et RCC1-like), à domaines RLD (RCC1-Like),
- les E3 restantes ne contiennent ni domaine RLD, ni WW.

Pour tout savoir sur les HECT humaines, lire : Mammalian HECT ubiquitin-protein ligases: Biological and pathophysiological aspects (2014) et Physiological functions of the HECT family of ubiquitin ligases (2009).
Structure
Dans la famille HECT, comme dans la famille RBR, l'ubiquitine est d'abord transférée :
À l'inverse, dans la famille RING, ce transfert se fait en une seule étape (
Les E3 reconnaissent les E2 par leur domaine UBC, domaine de conjugaison à l'ubiquitine qui contient la cystéine catalytique : les extensions N- et C-terminales spécifiques des E2 contribuent à leur spécialisation.
Domaine HECT
(Figure : vetopsy.fr)
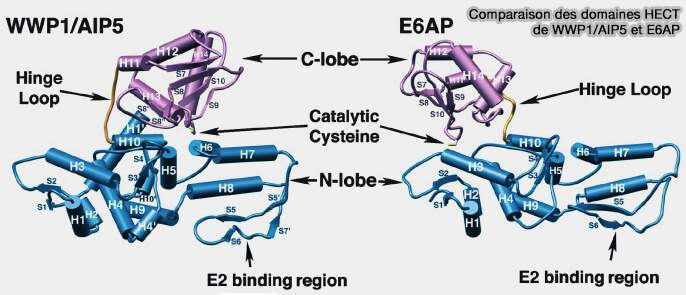
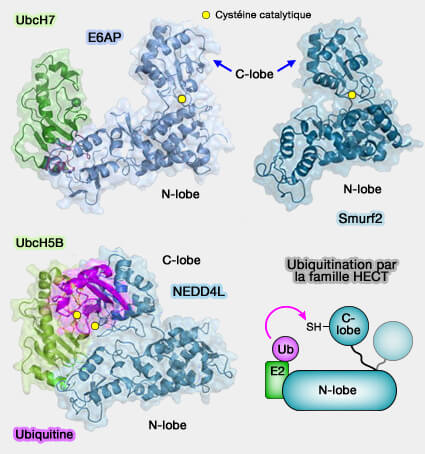
1. Le domaine HECT (Homologous to the E6-AP Carboxyl Terminus), d'environ 350 acides aminés, est toujours C-terminal et comporte deux lobes.
- Le lobe N-terminal entre en interaction avec l'enzyme de conjugaison E2 (E2 ubiquitin-conjugating enzyme).
- Le lobe C-terminal contient la cystéine du site catalytique qui forme le thioester avec l'ubiquitine.
2. Les deux lobes du domaine HECT sont reliés par une charnière souple qui permet leur réunion lors du transfert de l'ubiquitine.
La spécificité de liaison de la chaîne d'ubiquitine semble être intrinsèquement dépendante des 60 derniers acides aminés du lobe C-terminal (Polyubiquitination by HECT E3s and the determinants of chain type specificity 2009).
(Figure : vetopsy.fr d'après Verdecia et coll)
Autres domaines
Plusieurs autres domaines sont présents selon les sous-familles.
Sous-famille NEDD4/NEDD4-like
1. La sous-famille NEDD4/NEDD4-like comprend :
-
Famille HECT des E3 ubiquitine ligases
(Figure : vetopsy.fr d'après Kamadurai) - un domaine C2 N-terminal chez les NEDD4/NEDD4-like
Les domaines WW jouent aussi un grand rôle dans des interactions avec d'autres protéines (The Nedd4-like family of E3 ubiquitin ligases and cancer 2007).
2. Cette famille comprend entre autres :
- les Smurfs qui ubiquitinent les récepteurs TGF-β et les Smad,
- NEDD4 (Neural precursor cell Expressed Developmentally Down-regulated protein 4),
- NEDD4L ou Neural precursor cell expressed developmentally downregulated gene 4-like (Insights into ubiquitin transfer cascades from a structure of a UbcH5B~Ubiquitin-HECTNEDD4L complex 2010),
- ITCH (Itch: a HECT-type E3 ligase regulating immunity, skin and cancer 2008),
- WWP1 et WWP2,
- NEDL1 (A novel HECT-type E3 ubiquitin protein ligase NEDL1 enhances the p53-mediated apoptotic cell death in its catalytic activity-independent manner 2008),
- NEDL2 (The HECT Type Ubiquitin Ligase NEDL2 Is Degraded by Anaphase-promoting Complex/Cyclosome (APC/C)-Cdh1, and Its Tight Regulation Maintains the Metaphase to Anaphase Transition 2013).
Sous-famille HERC
1. La sous-famille HERC comprend 6 membres (HERC1 à 6) et contient :
- un domaine RLD (RCC1-like, car décrit dans Regulator of Chromosome Condensation 1) pour les plus petites E3, ou 2, pour les grandes E3,
- un domaine SPRY et un WD40.
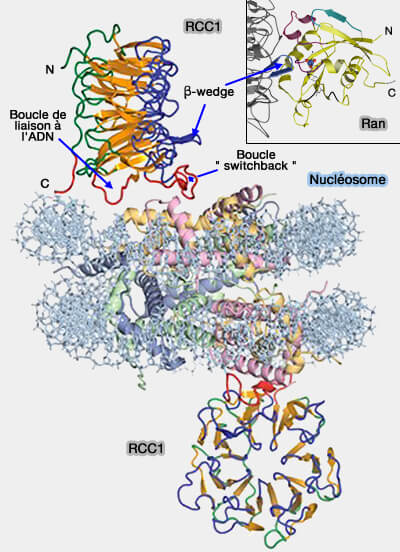
(Figure : vetopsy.fr d'après Song Tan)
2. Le domaine RLD canonique est constitué de sept répétitions de 50-70 acides aminés qui adoptent une structure de β-propeller - (The 1.7 Å crystal structure of the regulator of chromosome condensation (RCC1) reveals a seven-bladed propeller 1998 et Structural Basis for Guanine Nucleotide Exchange on Ran by the Regulator of Chromosome Condensation (RCC1) 2001).
- Dans RCC1, la β-wedge (wedge, " coin " ou " enfoncer ") se lie à la petite GTPase Ran.
- La boucle " switchback " (4C et 4D par Arg216 et Arg223) se lie à un patch acide du dimère de l'histone (Glu61, Asp90 et Glu92) et se trouve, non pas du côté opposé, mais sur le même côté que la β-wedge (Structure of RCC1 chromatin factor bound to the nucleosome core particle 2010 et film).
- La boucle de liaison à l'ADN se trouve entre les brins 4D et 5A.
3. Malgré son domaine RLD, RCC1 n'a rien à voir avec les E3 ubiquitine ligases (RCC1, un nouveau partenaire stabilisant le génome du virus d’Epstein-Barr 2024).
Sous-famille sans RDL ni WW
La dernière sous-famille hétéroclite contient :
- une ou deux répétitions armadillo et un domaine WWE (The WWE domain: a common interaction module in protein ubiquitination and ADP ribosylation 2001 et Recognition of the iso -ADP-ribose moiety in poly(ADP-ribose) by WWE domains suggests a general mechanism for poly (ADP-ribosyl)ation-dependent ubiquitination 2011) comme TRIP12/ULF ou HUWE1, aussi appelé UREB1, HECTH9, ARF-BP1, MULE, E3Histone ou LASU1),
- un domaine ZnF et PABP comme UBR5/EDD1 (Identification of phosphorylation sites on the E3 ubiquitin ligase UBR5/EDD 2011)
- un domaine ANK (pour Ankyrine) comme HACE1 (HECT domain and Ankyrin repeat-Containing E3 ubiquitin-protein ligase 1),
- un domaine UBA et BH3 - Bcl2 Homology region 3 - (Mule/ARF-BP1, a BH3-only E3 ubiquitin ligase, catalyzes the polyubiquitination of Mcl-1 and regulates apoptosis 2005), comme HUWE1.
Remarque : UBR5 est une N-recognin spéciale avec un domaine HECT alors que les UBR1/2/4 ont un domaine RING.


