Protéines
Dégradation : protéolyse (catabolisme protéique)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La protéolyse est un processus catabolique qui dégrade les protéines en peptides ou en acides aminés, participant au renouvellement des protéines et à l’homéostasie cellulaire.
Vue d'ensemble
La protéolyse désigne l’ensemble des processus conduisant à la dégradation des protéines en peptides ou en acides aminés, constituant ainsi la principale source d’acides aminés pour l’organisme (≈ 75 %, contre ≈ 25 % issus des apports alimentaires).
1. Elle est assurée majoritairement par des peptidases (protéases ou enzymes protéolytiques), classées parmi les hydrolases, qui clivent les liaisons peptidiques de manière contrôlée, spécifique et souvent régulée par des signaux cellulaires.
D’autres enzymes peuvent intervenir de façon indirecte en préparant ou en facilitant la dégradation, comme :
- les ubiquitine ligases, qui marquent les protéines pour leur élimination,
- les peptidyl-prolyl isomérases, qui modifient la conformation des liaisons proline-peptide, facilitant l’accès des protéases,
- les transglutaminases et les désaminases, qui modifient certaines protéines pour en altérer la stabilité, les rendant plus sensibles à la protéolyse,
- les DNases/RNases, qui interviennent souvent en parallèle pour dégrader d’autres macromolécules lors de processus coordonnés comme dans l'apoptose.
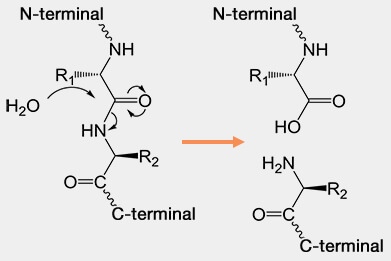
(Figure : vetopsy.fr)
2. Outre ces mécanismes enzymatiques, la protéolyse peut également résulter de processus non enzymatiques, moins fréquents et moins contrôlés.
- Certaines protéines peuvent subir une autoprotéolyse intramoléculaire spontanée par contraintes conformationnelles ou tensions internes dans leur structure.
- Des réactions d’hydrolyse chimique peuvent se produire naturellement, en particulier dans des environnements biologiques extrêmes, conduisant à la rupture des liaisons peptidiques sans intervention enzymatique.
3. Des facteurs physiques peuvent aussi déclencher la protéolyse de manière non spécifique.
- Une température élevée peut induire la dénaturation des protéines, altérant leur structure tridimensionnelle et les rendant plus sensibles à l’hydrolyse.
- De même, des variations importantes de pH peuvent perturber les interactions ioniques et hydrogène stabilisant les protéines, entraînant leur dépliement et facilitant leur fragmentation.
Ces mécanismes restent toutefois rares in vivo et surviennent principalement dans des conditions pathologiques, lors de stress cellulaires sévères.
Voies principales de protéolyse
La dégradation des protéines repose sur plusieurs systèmes protéolytiques spécialisés, chacun adapté à un contexte cellulaire particulier.
| Système protéolytique |
Localisation/ Origine |
Exemples | Fonctions principales |
|---|---|---|---|
| Système ubiquitine- protéasome (UPS) |
|
||
| Système endolysosomal et autophagique |
Lysosomes |
|
|
| Système calpaïne- calpastatine |
Cytosol |
|
|
| Protéolyse médiée par les caspases |
|
|
|
| Protéases spécifiques d'organites |
|
|
|
| Métalloprotéases |
|
|
Système ubiquitine-protéasome (UPS)
Le système ubiquitine-protéasome (UPS) constitue la principale voie de dégradation sélective, rapide et régulée des protéines cytosoliques et nucléaires.
Il joue un rôle central dans le maintien de l’homéostasie protéique en éliminant les protéines endommagées, mal repliées ou devenues inutiles, ainsi qu’en contrôlant de nombreux processus cellulaires.
1. Il repose sur un processus en deux étapes :
- l’ubiquitination, qui marque les protéines cibles par l’ajout de chaînes d’ubiquitine,
- leur dégradation par le protéasome 26S qui reconnaît les protéines polyubiquitinées.
Remarque : la dégradation par le protéasome n’est qu’un maillon d’un processus plus vaste, la protéostasie, qui englobe la surveillance de la qualité des protéines depuis leur synthèse jusqu’à leur élimination (
2. Le protéasome identifie ses cibles grâce à divers signaux de dégradation, appelés dégrons, parmi lesquels :
- les N-dégrons (règle N-terminale),
- les C-dégrons (règle C-terminale),
- des motifs internes, i.e. D-box, Ken-box, phospho-dégrons…
3. Ce mécanisme permet un contrôle précis de nombreuses fonctions cellulaires comme :
- la régulation du cycle cellulaire,
- la signalisation intracellulaire,
- la transcription et la réponse à divers stimuli,
- la réponse au stress oxydatif ou métabolique,
- l’élimination de protéines anormales ou potentiellement toxiques.

Le protéasome et l'ubiquitination sont étudiés dans des chapitres spécifiques.
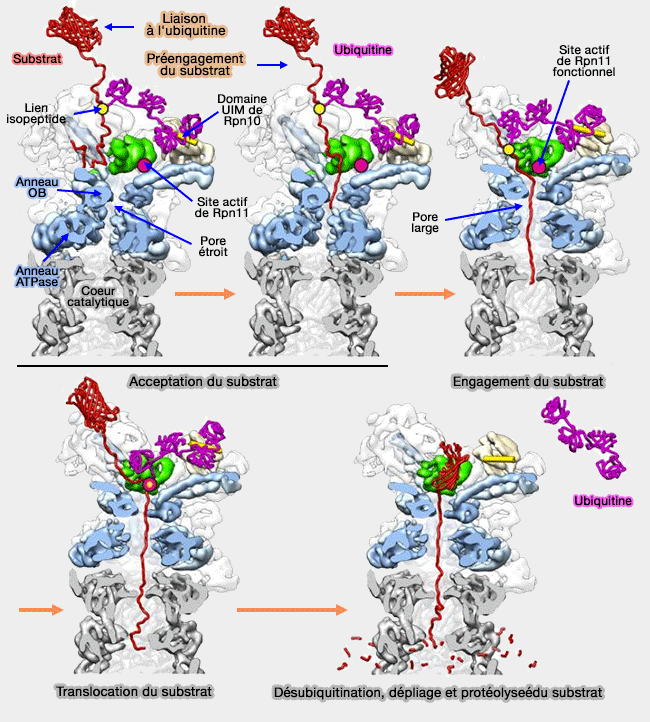
(Figure : vetopsy.fr d'après Lander)
Système endolysosomal et autophagique
Le système endolysosomal et autophagique prend en charge la dégradation non sélective ou globale de protéines, de complexes protéiques, de membranes et même d’organites entiers.
Il permet à la cellule de s’adapter à ses besoins métaboliques, de maintenir son équilibre interne et de renouveler ses composants.
1. La dégradation repose sur plusieurs voies d’entrée vers le lysosome, organite qui incorpore les protéines à dégrader (
- par voie endocytaire, impliquant l’internalisation de protéines membranaires ou extracellulaires,
- par microautophagie endosomale, séquestration sélective ou pas de protéines membranaires dans les endosomes sous forme de vésicules intraluminales (ILV),
- par autophagie médiée par des protéines chaperonnes (CMA), assurant l’import sélectif de protéines cytosoliques,
- par macroautophagie, qui forme un autophagosome englobant des portions de cytoplasme ou des organites,
- par microautophagie lysosomale, impliquant l’absorption directe de composants cytoplasmiques.
2. Ce système joue un rôle central dans :
- le maintien de l’homéostasie cellulaire à long terme,
- la réponse au stress métabolique ou environnemental,
- le renouvellement des composants cellulaires, y compris les organites endommagés.

Les lysosomes et toutes les formes d'autophagie sont étudiés dans des chapitres spécifiques.

(Figure : vetopsy.fr d'après Kuchitssu et Tagushi)
Système calpaïne-calpastatine
Le système calpaïne-calpastatine est constitué de protéases cytosoliques calcium-dépendantes qui interviennent dans la dégradation ciblée et contrôlée de protéines intracellulaires, en particulier celles :
- du cytosquelette, i.e. actine, spectrine, taline, tubuline, vimentine…
- des complexes d’adhésion, i.e. FAK (focal adhesion kinase), paxilline, vinculine, β-caténine…
- de certaines protéines membranaires, i.e. E-cadhérine, NCAM (Neural Cell Adhesion Molecule), EGFR (récepteur de l’EGF)…
1. L’activation des calpaïnes est déclenchée par une élévation transitoire de la concentration en calcium intracellulaire, ce qui leur permet de remodeler rapidement l’architecture cellulaire et de moduler divers processus comme (Calpain-calpastatin system and cancer progression 2021) :
- la migration,
- la différenciation,
- la signalisation.
2. Leur activité est finement régulée par la calpastatine, un inhibiteur spécifique qui empêche une dégradation excessive et préserve l’intégrité cellulaire.
Caspases : un système protéolytique spécialisé
Contrairement aux systèmes protéolytiques principalement dédiés à la dégradation et au recyclage des protéines, les caspases constituent un mécanisme spécialisé dont l’activité est déclenchée uniquement dans des contextes biologiques précis.
1. Leur fonction première n’est pas d’assurer l’homéostasie protéique, mais d’exécuter des programmes cellulaires complexes comme :
- l’apoptose ou la pyroptose,
- certaines étapes de la différenciation,
- la maturation de cytokines au cours de l’inflammation.

L'apoptose est étudiée dans un chapitre spécifique.
2. Produites sous forme de pro-caspases inactives, elles sont activées par clivage en réponse à des signaux de mort cellulaire tels que les dommages irréparables à l’ADN ou l’activation de récepteurs spécifiques.
a. Deux grandes classes de caspases orchestrent cette cascade.
- Les caspases initiatrices, i.e. caspase-8, 9 déclenchent l’activation séquentielle du système.
- Les caspases effectrices, i.e. caspase-3, 6, 7 clivent des substrats cellulaires clés.
b. L’action des caspases ne se limite pas à dégrader les protéines : elle provoque leur activation ou leur inactivation fonctionnelle par clivage ciblé, réorganisant ainsi en profondeur les structures et les processus cellulaires. comme celles :
- du cytosquelette, i.e. clivage de l’actine, des lamines ou de la gelsoline, conduisant à la désorganisation de l’architecture cellulaire,
- des complexes nucléaires, i.e. activation de la CAD (Caspase-Activated DNase) par clivage de son inhibiteur ICAD (DFFA) provoquant la fragmentation contrôlée de l’ADN,
- des facteurs de régulation, i.e. inactivation de PARP (poly-ADP ribose polymérase), impliquée dans la réparation de l’ADN, participant à l’arrêt définitif des fonctions cellulaires.
Protéases spécialisées : organites et métalloprotéases
Pour être complet, certaines protéases présentent une spécialisation fonctionnelle, intervenant dans des contextes cellulaires précis.
1. Certaines protéases sont spécifiques d’organites impliquées dans l’élimination ou la maturation de protéines internes comme celles :
- des mitochondries, i.e. AAA-protéases, OMA1, PARL qui contrôlent la qualité des protéines membranaires internes,
- des peroxysomes, protéases spécialisées comme les trypsine-like, chymotrypsine-like et caspase-like, qui assurent le clivage des protéines ubiquitinées en petits peptides.
2. les métalloprotéases, i.e. les MMP (Matrix Metalloproteinases), ADAM (A Disintegrin And Metalloprotease) et ADAMTS participent :
- à la dégradation de la matrice extracellulaire 'ECM),
- au remodelage tissulaire,
- à la signalisation par clivage de récepteurs.
Protéases (peptidases ou enzymes protéolytiques)
BiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéines Domaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesDegronsUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


