Complexe APC/C
Régulation extrinsèque
1. Régulation par phosphorylation et inhibition par EMI1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La régulation extrinsèque de l’APC/C coordonne son activation et son inhibition au cours de la mitose, notamment par phosphorylation de ses sous-unités et par le contrôle exercé par EMI1.
Vue d'ensemble de la régulation
La régulation du complexe APC/C (Anaphase-Promoting Complex/Cyclosome) constitue un mécanisme de surveillance essentiel pour maintenir la succession spatio-temporelle des transitions mitotiques.
Elle empêche toute activation prématurée ou prolongée du complexe, évitant ainsi une dégradation aberrante des substrats clés du cycle.
1. Cette régulation repose sur deux niveaux complémentaires.
a. La régulation extrinsèque est un contrôle exercé par des signaux externes au complexe, assurant son activation ou son inhibition en fonction de l’état mitotique qui inclut :
- la phosphorylation des sous-unités de l’APC/C et l’inhibition par EMI1,
- le point de contrôle du fuseau mitotique (SAC),
- d’autres signaux mitotiques modulant l’activité du complexe.
b. la régulation intrinsèque est un contrôle interne dépendant des propriétés propres du complexe, impliquant :
- l’autoubiquitination de Cdc20, qui limite la durée d’activité d’APC/CCdc20 et amorce sa transition vers Cdh1 (
autoubiquitination et régulation intrinsèque de l’APC/C),
- le rétrocontrôle entre Cdc20, Cdh1 et les complexes SCF et réinitialisation du complexe avant la phase S.
2. Ainsi, l’APC/C s’intègre dans un réseau de régulations à la fois externes et internes, coordonnant les points de contrôle du fuseau (SAC), la sortie de mitose et la préparation du cycle suivant.
Régulation par phosphorylation/déphosphorylation
La phosphorylation/déphosphorylation contrôle l’état d’activation du complexe APC/C tout au long de la mitose (Mechanisms for the temporal regulation of substrate ubiquitination by the anaphase-promoting complex/cyclosome 2019).
(Figure : vetopsy.fr d'après Alfieri et coll)
APC/CCdc20
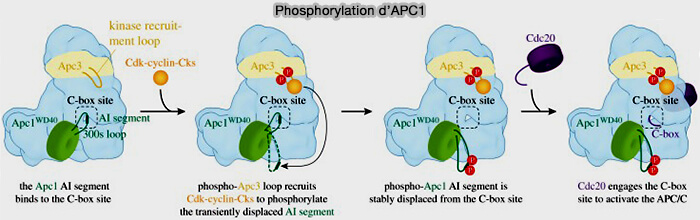
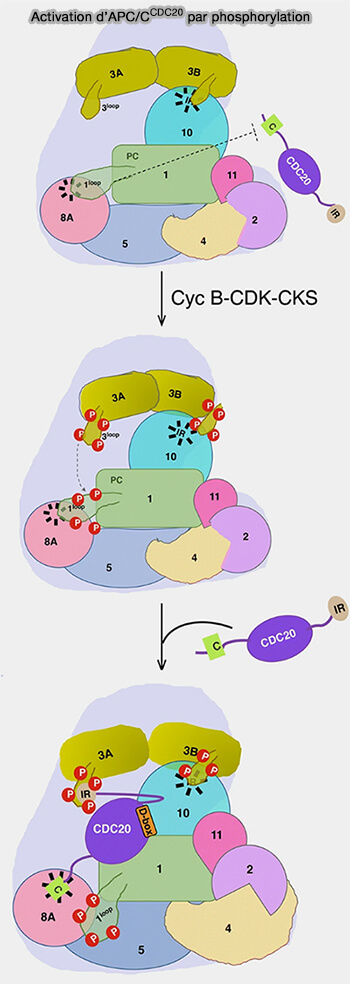
1. En prophase et en prométaphase, le complexe cycline B/CDK1-CKS phosphoryle plusieurs sous-unités structurales du complexe APC/C, provoquant la transition vers une conformation ouverte qui libère le site d’interaction de la C-box et permet le recrutement du coactivateur Cdc20.
- Pour APC1, sa boucle auto-inhibitrice se déplace après phosphorylation, libérant le site de liaison de la C-box sur APC8.
- Pour APC3, sa phosphorylation renforce le recrutement du module CKS-CDK1 et stabilise les interactions du module TPR.
- Pour APC8, sa phosphorylation à proximité du site de la C-box optimise l’ancrage du coactivateur.
- Pour APC4, bien que moins étudié, il subit aussi des phosphorylations mitotiques qui stabilisent l’interface avec APC2 et contribuent au verrouillage conformationnel du module catalytique.
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Remarque : CKS (Cyclin-dependent kinase subunit) est une petite protéine adaptatrice qui se lie au complexe cycline/CDK et module sa capacité à phosphoryler certains substrats ou à se localiser à des complexes spécifiques.
a. Dans l’APC/C non phosphorylé, le site de liaison de la C-box sur APC8 est occupé par une boucle auto-inhibitrice d’APC1, empêchant ainsi la C-box de Cdc20 de se lier à l’APC/C.
b. Le complexe cycline B/CDK1-CKS se fixe de manière transitoire sur une boucle accessible d’APC1, entre ses répétitions tétratricopeptide (TPR), où il catalyse la phosphorylation de plusieurs résidus sérine/thréonine.
Ces phosphorylations favorisent ensuite l’interaction renforcée du module CKS avec les sites phospho-S/T nouvellement créés, stabilisant la kinase sur l’APC/C et amplifiant localement la phosphorylation.
c. Cette interaction déclenche la phosphorylation de la boucle d’APC1, entraînant son détachement de la C-box et libérant le site pour que Cdc20 puisse se lier à APC.
d. Une fois que Cdc20 est associé, sa queue IR (isoleucine-arginine) interagit avec APC3A, tandis que la boucle phosphorylée d’APC3B interagit avec l’IR tail de la sous-unité APC10.

Ce repositionnement favorise le passage de la configuration CRL-down à CRL-up du cœur catalytique APC2-APC11, permettant l’ubiquitination des substrats.
APC/CCdc20 ➞ APC/CCdh1
Après la phase d’activation, lorsque les substrats majeurs de l’APC/CCdc20, la sécurine et la cycline B, ont été dégradés, l’activité de la kinase cycline B/CDK1 chute brutalement.
1. En l’absence de Cdc20, le complexe adopte un état partiellement inactif, ouvrant la voie à la substitution par Cdh1 (APC/C: current understanding and future perspectives 2019).
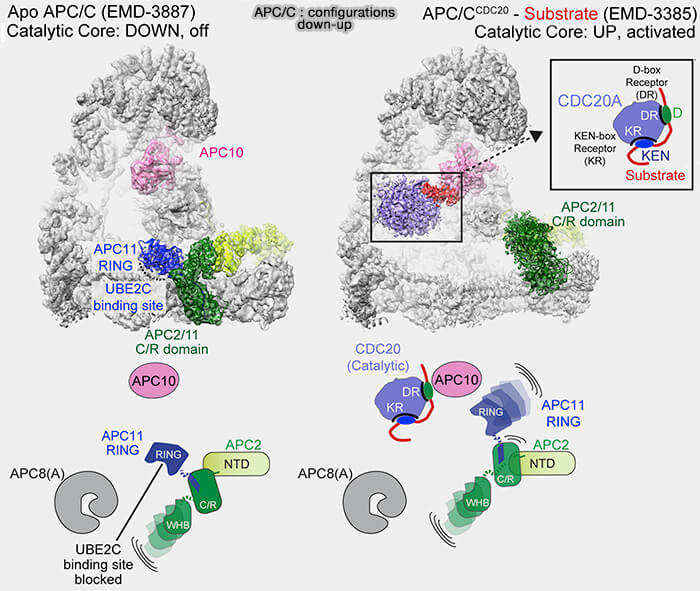
a. Cet état intermédiaire correspond à une forme apo transitoire, i.e. dans une conformation fermée et inactive.
La plateforme TPR (APC3, APC6, APC8) demeure intacte, mais le bras catalytique APC2-APC11 adopte une position repliée et relâchée, réduisant l’accessibilité des sites de liaison des E2.
b. Les sous-unités APC1 et APC3, phosphorylées en début de mitose par la cycline B/CDK1, commencent à être déphosphorylées par les phosphatases PP1 et PP2A-B55 qui interviennent dès la télophase.
(Figure : vetopsy.fr)
2. Cet affaiblissement catalytique et structural joue un rôle préparatoire essentiel.
- Il empêche toute ubiquitination non spécifique pendant la phase de transition, évitant un chevauchement des coactivateurs d’activité entre Cdc20 et Cdh1.
- Il prépare la reconversion du complexe en conformation ouverte, rendue possible par la déphosphorylation d’APC1 et d’APC3.
- Il crée un environnement favorable à la fixation de Cdh1, dont la C-box présente une affinité plus élevée pour l’état non phosphorylé de l’APC/C et dont la liaison rétablira la forme ouverte catalytiquement active de l’APC/C.
3. La liaison de Cdh1 stabilise la forme ouverte active de l’APC/C, marquant la transition fonctionnelle vers APC/CCdh1, responsable de la dégradation des substrats résiduels de la mitose et de la préparation de la phase G1.
Ainsi, la phosphorylation induit l’ouverture du complexe et permet le recrutement de Cdc20, tandis que la déphosphorylation favorise l’association stable de Cdh1, assurant la progression séquentielle des événements mitotiques et la remise à l’état initial du complexe en fin de cycle.
Remarque : des mécanismes internes assurent la désactivation séquentielle du complexe, comme l’autoubiquitination de Cdc20 et la réinitialisation structurale de l’APC/C (
(Figure : vetopsy.fr d'après Yamaguchi et coll)
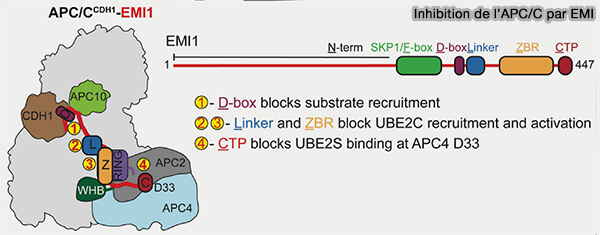
Inhibition par EMI
EMI1 (Early Mitotic Inhibitor 1), protéine modulaire d’environ 450 acides aminés et régulateur négatif clé d’APC/CCdh1 avant la mitose, comprend deux régions qui coopèrent pour bloquer à la fois le site de reconnaissance des substrats et la machinerie catalytique du complexe (Examining the mechanistic relationship of APC/CCDH1 and its interphase inhibitor EMI1 2022).
Dans l’état actif APC/CCdh1, les substrats sont recrutés via leurs motifs D-box, KEN-box ou motif ABBA reconnus par Cdh1 et APC10, qui forment ensemble la surface de capture.
Structure et inhibition
1. La région N-terminale désordonnée d'EMI comporte plusieurs motifs d’interaction avec l’APC/C (Examining the mechanistic relationship of APC/CCDH1 and its interphase inhibitor EMI1 2022).
- Sa pseudo-D-box (RxxLxxI) se fixe exactement dans la même poche que celle utilisée par un substrat réel sur Cdh1, agissant comme un leurre compétitif.
- Sa KEN-box renforce cet ancrage sur la sous-unité APC10, verrouillant la position d’EMI1 sur la plateforme du substrat.
Ainsi, EMI1, occupant le site de liaison des substrats sur l’APC/CCdh1 et bloquant toute ubiquitination dépendante de Cdh1, prévient la dégradation prématurée des cyclines A et E, indispensables à la transition G1/S, et prépare la cellule à la réactivation du cycle (Cryo-EM structures of apo-APC/C and APC/CCDH1:EMI1 complexes provide insights into APC/C regulation 2024)
(Figure : vetopsy.fr d'après Bohlhuis et coll)
2. La région C-terminale structurée d'EMI contient un domaine ZBR (Zinc-Binding Region) qui stabilise un repli compact et se lie directement au module catalytique APC2-APC11.
a. La région ZBR d’EMI1 s’insère au contact direct du module APC2-APC11, qui forme le bras catalytique du complexe en interagissant avec :
- la sous-unité RING d’APC11, responsable de la réception de l’ubiquitine depuis l’E2,
- la surface adjacente d’APC2, sur laquelle se place normalement le substrat au moment du transfert d’ubiquitine.
b. Cette double interaction bloque mécaniquement le positionnement de l’E2 (Ube2C ou Ube2S) et empêche la catalyse de la réaction d’ubiquitination, même si le substrat était reconnu.
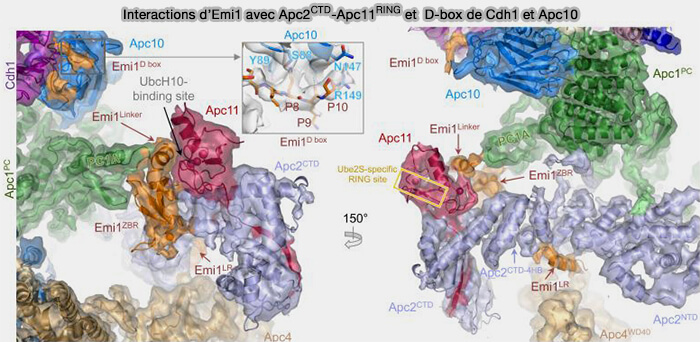
(Figure : vetopsy.fr d'après Chang et coll)
3. Le LRR (Linker Regulatory Region) flexible relie le segment N-terminal au domaine ZBR, maintenant le complexe dans un état verrouillé où ni les substrats, ni les E2 (Ube2C, Ube2S) ne peuvent se positionner correctement.
- Dans la structure inhibée, le LRR traverse l’interface entre le module TPR (APC3, APC6, APC8) et la plateforme catalytique, contribuant à stabiliser la conformation compacte du complexe.
- Le LRR oriente le domaine ZBR de façon optimale pour qu’il s’enchâsse dans la poche formée par APC2 et APC11.
Cette orientation précise renforce la coopérativité entre les deux extrémités d’EMI1 (EM Structure of human APC/CCDH1-EMI1 reveals multimodal mechanism of E3 ligase shutdown 2014).
- La région N-terminale bloque l’entrée des substrats.
- Le domaine ZBR, guidé par le LRR, empêche le transfert d’ubiquitine.
Dynamique de régulation au cours du cycle
EMI1 intervient aux stades tardifs de l’interphase et au début de la mitose, où elle régule finement l’activation séquentielle de l’APC/C afin de prévenir toute dégradation prématurée des substrats mitotiques.
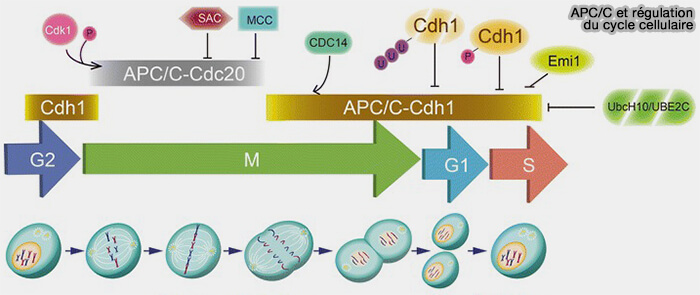
(Figure : vetopsy.fr d'après Zhou et coll)
1. Pendant la phase S et le début de la G2, EMI1 s’accumule et maintient l’APC/CCdh1 inactif, garantissant la stabilité des cyclines et la progression de la réplication.
2. En fin de G2, l’activation progressive des complexes cycline A/CDK1 puis cycline B/CDK1 conduit à la phosphorylation hiérarchique d’EMI1 sur plusieurs résidus de sa région N-terminale, notamment Ser124, Ser128, Ser131 et Thr145.
La phosphorylation initiale de Ser124 par cycline A/CDK1 crée un site d’amorçage qui facilite la phosphorylation des résidus adjacents par cycline B/CDK1.
a. La phosphorylation modifie plusieurs sites clés responsables de sa liaison au complexe, et provoque :
- une perte d’affinité des motifs D-Box et KEN-box d’EMI1 pour Cdh1 et APC10,
- une instabilité conformationnelle du segment LRR, qui ne peut plus maintenir la tension entre la plateforme de reconnaissance et le bras catalytique.

Ces résidus phosphorylés forment un motif de reconnaissance DSGxxS pour la sous-unité β-TrCP du complexe SCFβ-TrCP.
b. Le domaine ZBR d’EMI1, ancré sur le module catalytique APC2-APC11, reste initialement fixé plus longtemps que la partie N-terminale.
- La phosphorylation des boucles environnantes d’APC3 et d’APC1, catalysée par cycline B/CDK1-CKS, modifie localement la charge électrostatique du complexe, affaiblissant l’interaction ZBR/APC11.
- Cette étape complète le désengagement d’EMI1, permettant au bras catalytique APC2-APC11 de retrouver sa mobilité.
Remarque : pendant cette même période, EMI1 exerce une inhibition transitoire sur le complexe APC/C-Cdc20, en occupant les sites normalement destinés à la fixation du coactivateur et de l’enzyme E2, empêchant ainsi toute ubiquitination prématurée des substrats mitotiques (
3. Une fois phosphorylée, EMI1 est reconnue par le complexe SCFβ-TrCP qui déclenche sa polyubiquitination et sa dégradation rapide par le protéasome 26S au début de la prophase.
- Cette dégradation libère l’APC/C, qui peut alors recruter Cdc20 et l’activation d’APC/CCdc20, responsable de la dégradation séquentielle de la sécurine et des cyclines B.
- Pendant la sortie de mitose, la chute de l’activité cycline B/CDK1 et la déphosphorylation progressive de Cdh1, assurée principalement par PP2A-B55 et PP1 chez les mammifères, permettent la formation du complexe APC/CCdh1, actif en G1.
La succession de ces étapes assure la coordination temporelle entre inactivation d’EMI1, activation de l’APC/CCdc20 et retour de l’APC/CCdh1 en fin de cycle.


