Complexe APC/C
Cdc20 : coactivateur mitotique
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Cdc20 active l’APC/C durant la métaphase-anaphase, déclenchant la dégradation rapide de la sécurine et des cyclines B, étape décisive qui libère la séparase et initie la séparation des chromatides sœurs.
L’APC/C requiert des cofacteurs temporaires pour sa pleine activité :
- Cdc20 (Cyclosome division cycle 20), actif pendant la métaphase-anaphase,
- Cdh1 (Cdc20 homolog 1), actif durant la fin de mitose et la phase G1.
Ces coactivateurs confèrent à l’APC/C sa spécificité de substrat et sa régulation temporelle, assurant la succession ordonnée des événements de dégradation indispensables à la progression mitotique et à la transition vers la phase G1.

L'organisation générale des coactivateurs Cdc20 et Cdh1 est étudiée dans un chapitre spécifique.
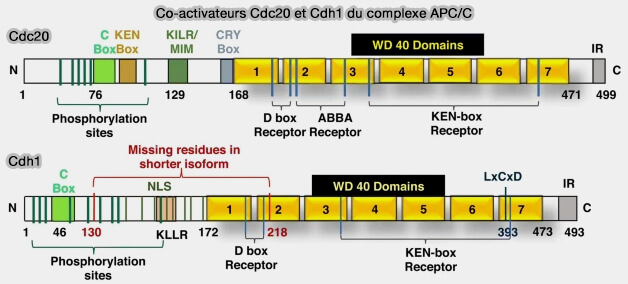
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Cdc20, coactivateur mitotique du complexe APC/C
Cdc20 (Cyclosome division cycle 20) constitue le coactivateur principal de l’APC/C durant la prométaphase et la métaphase, période où il orchestre la dégradation séquentielle des substrats mitotiques précoces nécessaires à la transition vers l’anaphase (The interaction profile between CDC20 and the components of the anaphase promoting complex or cyclosome (APC/C) in human Hela cells 2019).
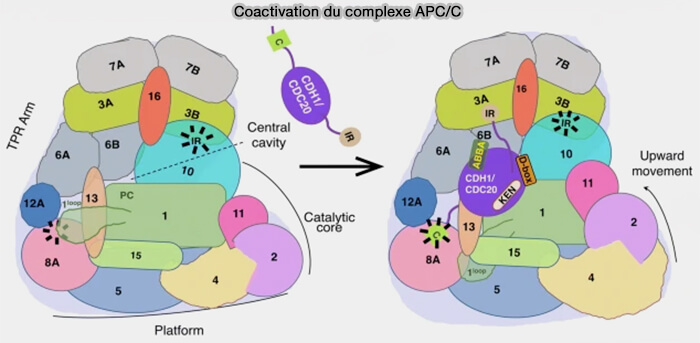
(Figure : vetopsy.fr d'après Bansal et Tiwari)
Dégradation séquentielle des substrats de l’APC/CCdc20
1. La dégradation coordonnée des substrats de l’APC/CCdc20 déclenche la séparation des chromatides et engage une progression irréversible vers la fin de la division cellulaire, marquant le déclenchement de l’anaphase.
- La cycline A est éliminée en premier, levant l’inhibition de l’APC/C et permettant la pleine activation du complexe en métaphase.
- La sécurine est ensuite dégradée, libérant la séparase, enzyme responsable du clivage de la cohésine qui maintenait les chromatides sœurs appariées.
- Enfin, la cycline B1 est détruite, provoquant l’inactivation progressive du complexe cycline B/CDK1 (MPF), ce qui consolide la sortie de mitose et la réorganisation du cytosquelette.
2. APC/CCdc20 cible aussi plusieurs protéines impliquées dans l’organisation du fuseau mitotique et contribue ainsi au remodelage progressif des structures microtubulaires et au désassemblage ordonné des complexes mitotiques.
a. Nek2A, localisée aux centrosomes, est un substrat direct et précoce de Cdc20, juste après la cycline A, et sa dégradation, initiée dès la métaphase (Nek2A prevents centrosome clustering and induces cell death in cancer cells via KIF2C interaction 2024) :
- facilite la séparation des centrosomes,
- empêche leur reclustering, i.e. reformation anormale d’un seul pôle à partir de plusieurs centrosomes, phénomène fréquent dans les cellules cancéreuses multipolaires,
- stabilise la formation du fuseau bipolaire.
b. Plk1 est un régulateur clé du fuseau et de la cytokinèse et sa dégradation plus tardive est dépendante de Cdc20 (Structural regulation of PLK1 activity: implications for cell cycle function and drug discovery 2025) :
- désactive les pôles du fuseau,
- favorise la réorganisation du réseau microtubulaire,
- contribue à la transition télophase-cytokinèse.
3. La dégradation séquentielle de la cycline A, suivie de celle de Nek2A, puis de la sécurine et enfin de la cycline B1 et de Plk1, illustre la hiérarchie temporelle des substrats de Cdc20 :
- d’abord la levée des verrous chromosomiques,
- ensuite la désactivation des structures mitotiques et la préparation de la sortie de mitose.
Reconnaissance des substrats
Cdc20 initie la phase mitotique de l’activité de l’APC/C en ciblant principalement les substrats porteurs de D-box.
- Ces motifs, présents sur des protéines mitotiques majeures comme la cycline B1 ou la sécurine, sont associés à des dégradations rapides et précoces, nécessaires à la transition métaphase-anaphase.
- La reconnaissance préférentielle du D-box permet à Cdc20 de cibler des protéines dont la destruction doit être immédiate pour déclencher la séparation des chromatides.
Remarque : après la dégradation de Cdc20 en fin de mitose, l’activité du complexe est relayée par Cdh1, qui confère à l’APC/C une nouvelle spécificité de reconnaissance, orientée vers les substrats porteurs de KEN-box et de motif ABBA.
Cette succession de coactivateurs garantit la continuité fonctionnelle de l’APC/C depuis la phase mitotique jusqu’à la G1 et assure la transition ordonnée vers la sortie de mitose.
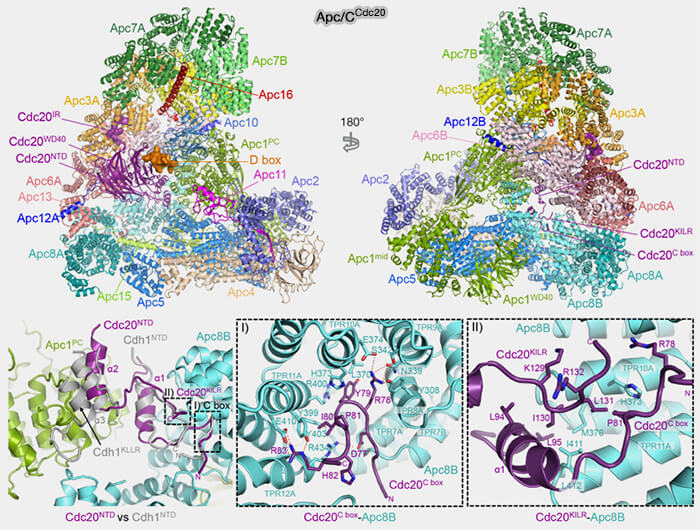
(Figure : vetopsy.fr d'après Zhang et coll)
Régulation et activation
L’activité de Cdc20 est soumise à un contrôle rigoureux qui coordonne son association à l’APC/C avec l’état d’achèvement du fuseau mitotique.
Autoinhibition conformationnelle de Cdc20
1. En prométaphase, une fraction importante de Cdc20 est déjà présente dans le cytosol, mais sous une forme autoinhibée incapable de s’associer à l’APC/C (A tripartite mechanism catalyzes Mad2-Cdc20 assembly at unattached kinetochores 2021).
- Ce mécanisme repose sur des contraintes structurales internes de la protéine, modulées par les phosphorylations mitotiques et la liaison au complexe APC/C.
- Cette régulation garantit que l’activité ubiquitine-ligase de l’APC/C ne soit déclenchée qu’après satisfaction du SAC et activation complète du complexe (
levée du SAC).
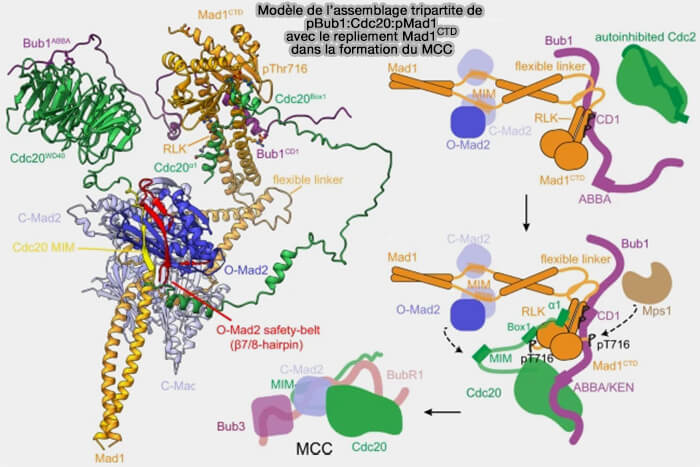
(Figure : vetopsy.fr d'après Fischer et coll)
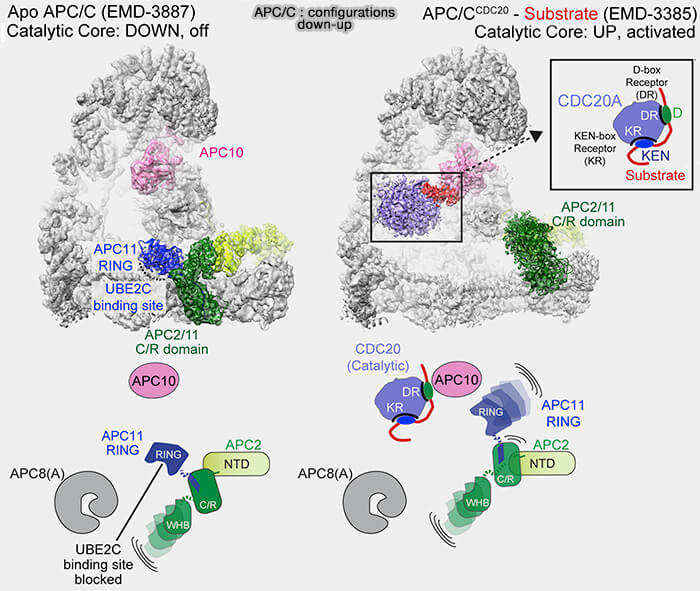
2. En l’absence de liaison à l’APC/C, le domaine WD40 de Cdc20 adopte une conformation repliée qui masque partiellement les interfaces d’interaction nécessaires à la fixation du coactivateur sur la plateforme TPR (APC3, APC6, APC8) et à la reconnaissance des substrats.
a. La boucle flexible N-terminale (~résidus 90-130) se replie sur la surface du domaine WD, bloquant l’accès au sillon canonique où se fixent les substrats de type D-box et KEN-box des substrats mitotiques.
b. Plusieurs kinases, principalement CDK1 (MPF) et MPS1, phosphorylent des résidus sérine/thréonine de l'extrémité N-terminale de Cdc20, i.e. Ser41, Thr55, Ser72, Ser92 selon les espèces.
- Ces groupements phosphates augmentent la charge négative de la région N-terminale, ce qui renforce les interactions électrostatiques internes avec le WD40 et stabilise le repliement autoinhibiteur.
- Cette phosphorylation est donc un verrou structurel, empêchant le déploiement du N-terminal et la présentation du D-box-binding site nécessaire à la reconnaissance des substrats.
c. Cette inactivation transitoire par la phosphorylation empêche toute activation prématurée du complexe tant que le fuseau mitotique n’est pas correctement assemblé (
2. Lorsque les kinétochores non attachés déclenchent le SAC, MPS1 et les protéines Mad1-C-Mad2 recrutent cette forme de Cdc20 inactivée pour former le MCC (
Régulation post-traductionnelle : phosphorylation et ubiquitination
Les mécanismes post-traductionnels assurent un contrôle temporel précis de l’activité de Cdc20, en modulant successivement son activation et sa désactivation.
Ils ne constituent pas un mode de régulation indépendant, mais s’intègrent aux processus décrits dans les chapitres précédents.
1. La phosphorylation du domaine N-terminal, principalement par cycline B/CDK1 et MPS1, maintient Cdc20 dans une conformation autoinhibée jusqu’à la levée du SAC (
Sa déphosphorylation par PP1 et PP2A-B56 libère ensuite le coactivateur et permet sa fixation sur l’APC/C.
(Figure : vetopsy.fr d'après Alfieri et coll)
2. En situation de dommages à l’ADN ou de réplication incomplète, la voie ATR-Chk1 et ATM/Chk2 inhibe également Cdc20 pour bloquer l’activation du MPF et donc l’entrée en mitose en (
- réduisant son affinité pour APC/C, i.e. empêchant la formation du complexe APC/CCdc20,
- stabilisant la cycline B.
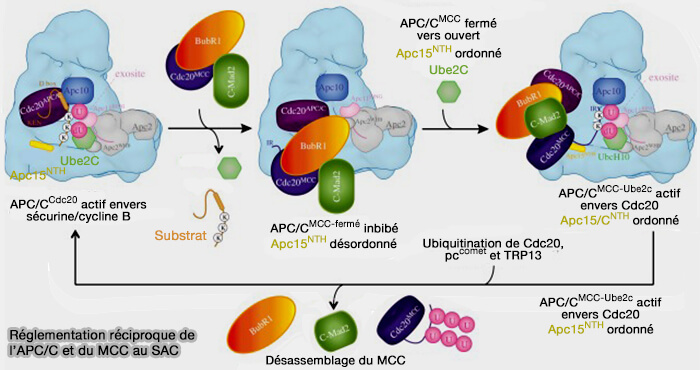
2. En fin d’anaphase, l’autoubiquitination de Cdc20 par le module APC2-APC11, en coopération avec Ube2C et Ube2S, provoque sa désactivation et sa dégradation partielle, assurant la transition vers Cdh1 (
Ainsi, la phosphorylation contrôle l’entrée en activité du coactivateur, tandis que l’ubiquitination en détermine la sortie, fermant la boucle de régulation d’un cycle mitotique à l’autre.
Régulation par les inhibiteurs mitotiques : EMI1 et MCC
(Figure : vetopsy.fr d'après Yamaguchi et coll)
En amont de son activation, Cdc20 est soumis à un ensemble d’inhibitions mitotiques qui garantissent une activation exclusivement synchronisée avec la levée du SAC (Spindle Assembly Checkpoint).
Ces régulations extrinsèques s’exercent à deux niveaux complémentaires.
1. EMI (Early Mitotic Inhibitor 1), en phase G2 et au début de la prométaphase, s’associe au cœur de l’APC/C et occupe le site de recrutement de Cdc20 ainsi que la région du module catalytique APC2-APC11.
- Cette protéine bloque l’activité de l’APC/C en occupant simultanément les sites de liaison du coactivateur Cdc20 et de l’enzyme E2.
- Elle agit comme un leurre compétitif, empêchant la formation d’un complexe APC/CCdc20 actif et toute ubiquitination prématurée des substrats mitotiques.
- Sa dégradation par le complexe SCFβ-TrCP, au début de la mitose, supprime cette inhibition initiale et permet la constitution effective du complexe APC/CCdc20 (
dégradation par SCF).
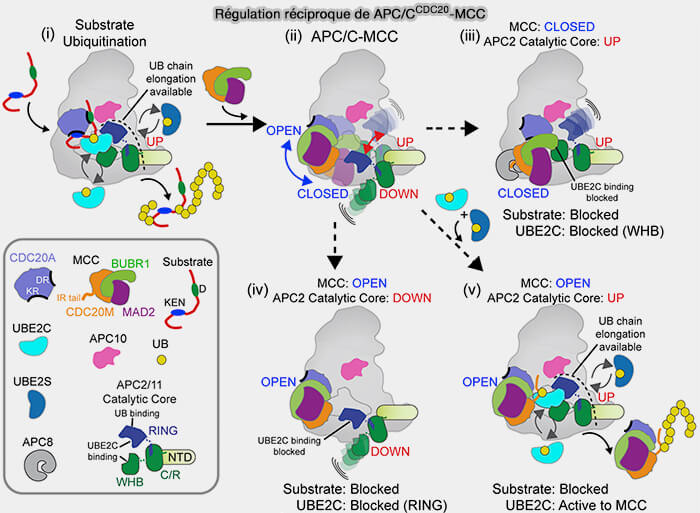
2. Le MCC, i.e. Mad2-BubR1-Bub3-Cdc20, durant la prométaphase, inhibe le complexe APC/C tant que la tension sur les kinétochores n’est pas uniforme, ce qui empêche la dégradation prématurée de la sécurine et des cyclines B.
- Lorsque les kinétochores non attachés déclenchent le SAC, MPS1 et le complexe Mad1-C-Mad2 recrutent cette forme de Cdc20 inactivée pour former le MCC (
formation du pre-mCC et du MCC).
- Cdc20 est capturé dans un complexe inhibiteur actif, où il ne participe plus à la catalyse, mais sert de plate-forme de couplage avec C-Mad2, BubR1 et Bub3, assurant la neutralisation temporaire de l’APC/C.
Remarque : les états successifs de Cdc20, depuis sa forme inhibitrice intégrée au MCC, i.e. Cdc20M, jusqu’à sa forme active associée à l’APC/C, i.e. Cdc20A, ne correspondent pas à des conformations stables, mais à une succession dynamique d’intermédiaires transitoires observés par cryo-EM au cours de la transition prométaphase-métaphase.
3. Lorsque le SAC est levé, le complexe MCC est démonté et le Cdc20 est libéré (
a. La libération de Cdc20 est dépendante de plusieurs mécanismes.
- L’inactivation de MPS1 déclenche le démontage du MCC, facilité par p31comet et TRIP13, qui convertissent C-Mad2 en sa forme ouverte (O-Mad2), conversion provoque la rupture de la liaison entre le MIM/KILR de Cdc20 et C-Mad2, libérant Cdc20 de la séquestration checkpoint-dépendante.
- La phosphorylation préalable d’APC1 et d’APC3 par le complexe cycline B/CDK1 (MPF) a libéré les sites de liaison de la C-box, permettant le recrutement de Cdc20 sur la plateforme TPR (APC3, APC8).
- Parallèlement, les phosphatases PP1 et PP2A-B56 déphosphorylent les résidus régulateurs du N-terminal de Cdc20, régulateurs du domaine N-terminal de Cdc20, permettant son ancrage stable sur la plateforme TPR (APC3, APC8).
b. Cdc20 adopte alors une conformation “ ouverte ”, dans laquelle son domaine WD40 expose les poches de liaison D-box et KEN-box, lui permettant de reconnaître et de recruter les substrats mitotiques majeurs tels que la sécurine et la cycline B.
Ce mécanisme garantit que la séparation des chromatides sœurs ne débute qu’une fois l’attachement bipolaire assuré.
(Figure : vetopsy.fr d'après Yamaguchi et coll)
Conclusion sur Cdc20
1. La régulation de Cdc20 repose sur une succession hiérarchisée de mécanismes assurant son activation précise au moment adéquat du cycle mitotique.
- Les modulations intrinsèques, fondées sur les phosphorylations de son domaine N-terminal et sa conformation autoinhibée, garantissent son maintien inactif tant que le SAC est actif.
- Les régulations extrinsèques, exercées par EMI1 puis par le MCC, préviennent toute activation prématurée de l’APC/CCdc20 avant la ségrégation correcte des chromosomes.
- Enfin, l’autoubiquitination post-anaphase du coactivateur par le module APC2-APC11 met un terme à son activité et prépare la transition vers Cdh1, assurant la continuité du contrôle du cycle.
2. Cdc20 agit comme un coactivateur transitoire, rigoureusement contrôlé dans le temps et dans l’espace, dont l’activation brève mais décisive déclenche la dégradation séquentielle de la sécurine et des cyclines B, marquant la sortie ordonnée de mitose et la préparation du cycle suivant.
| Moment du cycle | État de Cdc20 | Mécanismes moléculaires | Conséquences fonctionnelles |
|---|---|---|---|
| G1/S/G2 | Présent mais inactif |
|
|
| Prophase | Toujours inactif |
|
Maintien de l’inactivité d’APC/CCdc20 |
| Prométaphase | Séquestré/ inhibé |
|
Blocage strict d’APC/CCdc20 tant que kinétochores non attachés |
| Métaphase | Activation conditionnée |
|
Préparation du déclenchement de l’anaphase |
| Transition métaphase ➞ anaphase A |
Activation maximale |
|
|
| Anaphase B/début de télophase |
Inactivation progressive |
|
|
| Sortie de mitose | Dégradation |
|
Disparition de Cdc20 permettant l’installation d 'APC/CCdh1 |
| G1 suivant | Absent/bas niveau |
|
|
| G2 du cycle suivant |
Réaccu- mulation |
|
Préparation à la mitose suivante |


