Système endo-lysosomal
Réticulum endoplasmique
Sites de contact membranaire (MCS) du RE
MCS RE/Golgi
- Vue d'ensemble du système endomembranaire
- Endosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les sites de contact membranaire (MCS) du réticulum endoplasmique (RE) contactent l'appareil de Golgi.
Les progrès récents de la biologie des MCS ont révélé leurs rôles clés dans les échanges inter-organites.

Vous pouvez lire : Here, There and Everywhere: The Importance of ER Membrane Contact Sites (2018) et The functional universe of membrane contact sites (2019).
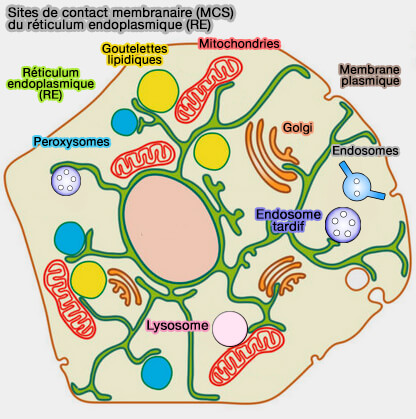
(Figure : vetopsy.fr d'après Inserm)
Les sites de contact membranaire (MCS) du réticulum endoplasmique (RE) avec les différents organites sont traités dans des chapitres spéciaux :
- MCS avec les endosomes ou corps multivésiculaires (MVE/MVB) et des lysosomes,
- MCS RE/Golgi,
- MCS RE/membrane plasmique,
- MCS RE/mitochondries,
- MCS RE/peroxysomes,
- MCS RE/gouttelettes lipidiques.
Vue d'ensemble des
MCS RE/Golgi
Le trafic des cargos entre le réticulum endoplasmique et le réseau trans-Golgi (TGN) peut emprunter deux routes distinctes (Coordinated Lipid Transfer between the Endoplasmic Reticulum and the Golgi Complex Requires the VAP Proteins and Is Essential for Golgi-mediated Transport 2008) :
- soit par des vésicules (Sphingomyelin is sorted at the trans Golgi network into a distinct class of secretory vesicle 2016),
- soit par MCS, i.e. trafic plus direct pour les transferts lipidiques.
Les MCS RE/Golgi sont favorisées, comme d'autres MCS du RE, par l'interaction du domaine MSP des protéines VAP (VAMP-Associated Protein) avec le domaine FFAT des protéines golgiennes que sont :
-
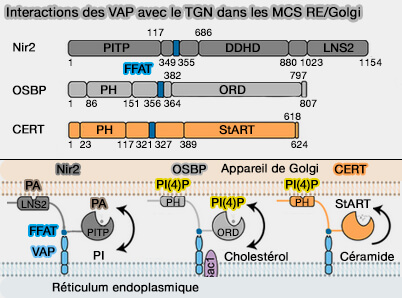
Interactions des VAP avec le TGN dans les MCS RE/Golgi
(Figure : vetopsy.fr d'après Wu et coll) - CERT (Ceramide transferase 1),
- PITPNM1 (Nir2).
OSBP
1. Par exemple, OSBP (Oxysterol-binding protein), membre de la famille ORP (OSBP-related proteins)/Oxysterol-binding homology (Osh) possède :
- un domaine PH (Pleckstrin Homology) pour se lier au PI(4)P, phosphoinositide dominant de la membrane golgienne,
- un domaine FFAT pour se lier aux VAP du RE,
- un domaine ORD (OSBP-Related Domain) pour le transport du cholestérol (Structure of human ORP3 ORD reveals conservation of a key function and ligand specificity in OSBP-related proteins 2021).
2. Les échanges de cholestérol entre le RE et le réseau trans-Golgi (TGN) dépendent du taux de PI(4)P (A Four-Step Cycle Driven by PI(4)P Hydrolysis Directs Sterol/PI(4)P Exchange by the ER-Golgi Tether OSBP 2013 et Osh4p exchanges sterols for phosphatidylinositol 4-phosphate between lipid bilayers 2011).
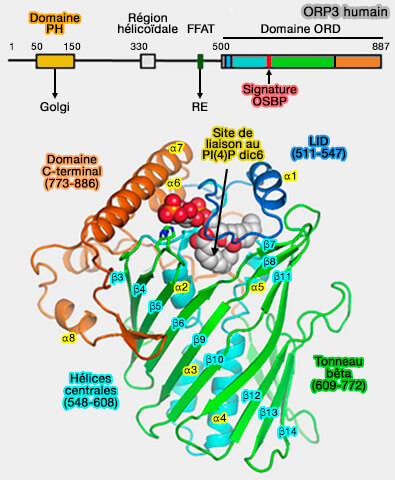
(Figure : vetopsy.fr d'après Tong et coll)
a. Lorsque les taux de PI(4)P sont élevés, le domaine ORD (OSBP-related domain) de l'OSBP facilite l'échange du cholestérol avec PI(4)P entre le RE et le TGN.
b. Lorsque les taux de PI(4)P sont bas, i.e. Sac1, la phosphatase du RE convertissant PI(4)P en phosphatidylinositol (PtdIns ou PI), l'échange du cholestérol se fait dans l'autre sens, i.e. TGN vers RE contre son gradient de concentration.
Remarque : le transport de la phosphatidylsérine (PS) est effectué par ORP5 et ORP8 (Oxysterol binding Related Proteins 5 et 8, Osh6 et 7 chez la levure).
3. Ce processus peut être facilité par PITPNM1 (Nir2), une protéine de transfert des lipides (LTP) de la famille des PITP qui se lie aussi aux VAP via une interaction MSP/FFAT (Differential Regulation of Endoplasmic Reticulum Structure through VAP-Nir Protein Interaction 2005).
- Nir2 peut transférer du PtdIns ou PI du RE au TGN.
- Le processus est bien décrit dans : The Interface Between Phosphatidylinositol Transfer Protein Function and Phosphoinositide Signaling in Higher Eukaryotes 2018).
Remarque : Nir2 intervient aussi dans les MCS RE/membrane plasmique.
CERT
1. CERT (Ceramide transferase 1), appelé aussi STARD11 ou COL4A3BP (Collagen type IV alpha-3-binding protein) dicte le rapport du céramide/sphingomyéline dans la cellule en transférant les céramides du RE au Golgi au niveau des MCS RE/Golgi, où le céramide sert de substrat à la synthèse de la sphingomyéline (Mechanisms involved in cellular ceramide homeostasis 2012 et Nonvesicular trafficking by a ceramide-1-phosphate transfer protein regulates eicosanoids 2014).

Vous pouvez lire : Ceramide Transfer Protein (CERT): An Overlooked Molecular Player in Cancer (2021).
Le réseau métabolique des sphingolipides est centré sur l'axe céramide-sphingomyéline.
-
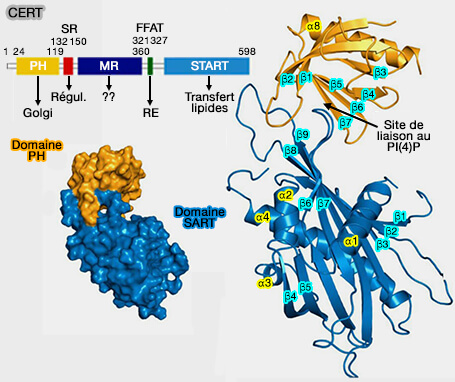
CERT (Ceramide transferase 1)
(Figure : vetopsy.fr d'après Prashek et coll) - Par conséquent, l'équilibre entre ces deux sphingolipides peut être critique pour la survie et le fonctionnement des cellules.
2. Comme OSBP, CERT possède (Interaction between the PH and START domains of ceramide transfer protein competes with phosphatidylinositol 4-phosphate binding by the PH domain 2017) :
- un domaine PH (Pleckstrin Homology) pour le cibler sur PI(4)P de l'appareil de Golgi,
- un domaine SR, i.e. riche en sérine,
- un domaine FFAT pour interagir avec les VAP localisés dans le RE (Efficient Trafficking of Ceramide from the Endoplasmic Reticulum to the Golgi Apparatus Requires a VAMP-associated Protein-interacting FFAT Motif of CERT 2006).
Le transfert des céramides du RE au Golgi est effectué par le domaine START (STeroidogenic Acute Regulatory Transfer-related lipid-tranfer).
Remarque : On trouve une mitoCERT qui régule la livraison de céramide aux mitochondries, notamment lors de l'apoptose intrinsèque (Diverting CERT-mediated ceramide transport to mitochondria triggers Bax-dependent apoptosis 2016).
Retour aux MCS du RE
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


