Lipides
Trafic non vésiculaire
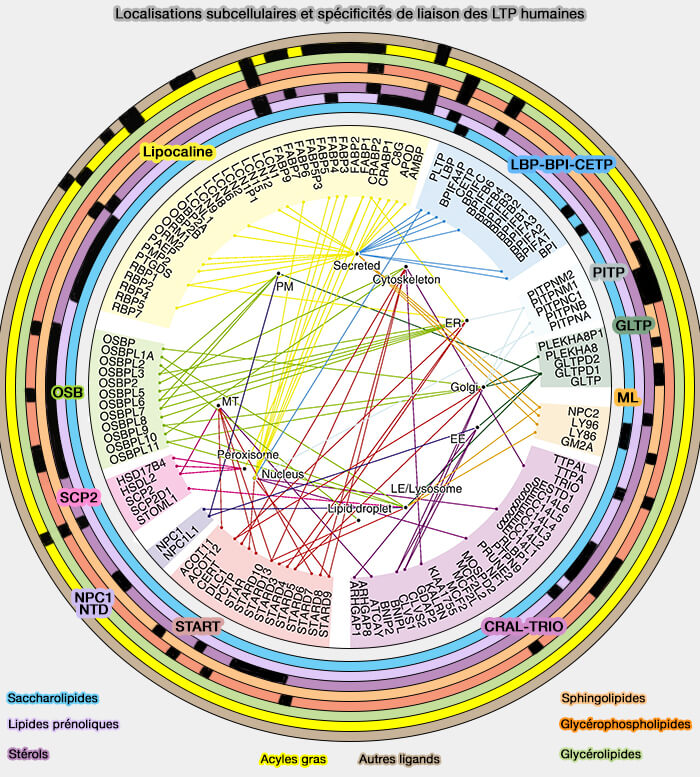
LTP ou protéines de transfert des lipides
Famille des PITP (Phosphatidylinositol (PI) Transfer proteins)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les protéines PIPT (Phosphatidylinositol (PI) Transfer proteins), protéines de transfert des lipides (LTP ou Lipid Tranfer Protein) sont impliquées dans leur trafic non vésiculaire par navette des phosphoinositides.
(Figure : vetopsy.fr d'après Chiapparino et coll)
1. Les LTP intracellulaires se localisent sur les sites de contact membranaire (MCS) au sein desquelles les LTP peuvent transférer les lipides d'un compartiment donneur à un compartiment accepteur (Lipid transfer proteins: the lipid commute by shuttles, bridges and tubes 2019).
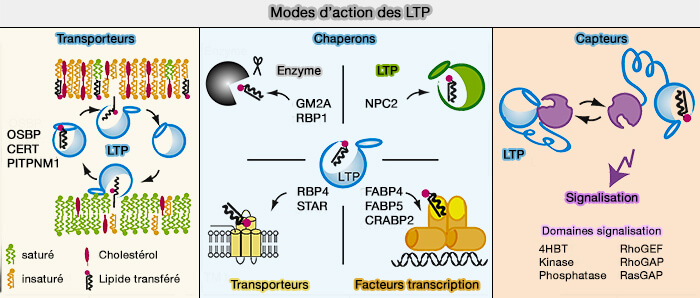
2. Les LTP peuvent remplir au moins l'une des trois fonctions principales dans les cellules en agissant comme (
- transporteurs pour transférer des lipides entre les membranes,
- chaperons pour présenter des lipides à une protéine acceptrice, i.e. enzymes, autres LTP, transporteurs transmembranaires ou facteurs de transcription,
- capteurs (détecteurs) pour modifier une interaction avec d'autres protéines en réponse à la liaison ou à la libération d'un lipide.
(Figure : vetopsy.fr d'après Chiapparino et coll)
Vue d'ensemble et classification des PITP
1. Les phosphoinositides (PI), dérivés phosphorylés du phosphatidylinositol (PtdIns ou PI), sont des régulateurs clés de divers processus cellulaires (Novel roles of phosphoinositides in signaling, lipid transport, and disease 2020).
Nous préférons garder, dans vetopsy.fr, l'abréviation PtdIns pour le phosphatidylinositol et PI pour les phosphoinositides en général pour éviter la confusion.

Les phosphoinositides, vu leur importance, sont étudiés en détail non seulement dans la biochimie avec les PI-kinases et les PI-phosphatases, mais aussi dans de nombreux chapitres du système endomembranaire et du transport membranaire.
2. Les phosphoinositides sont présents dans de nombreux compartiments sous-cellulaires, notamment l'appareil de Golgi, les endosomes/lysosomes et la membrane plasmique.
Cependant, comme le site de synthèse des PI est le réticulum endoplasmique (RE), la livraison de PI à d'autres compartiments membranaires est nécessaire (Phosphatidylinositol synthesis at the endoplasmic reticulum 2021).
(Figure : vetopsy.fr d'après Cockcroft et coll)
Classification des PITP
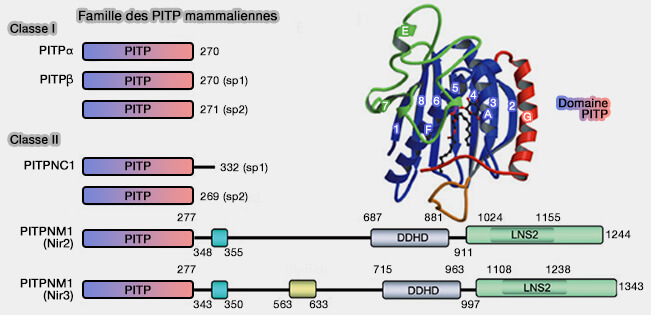
La famille PITP dans les cellules de mammifères comprend cinq membres, subdivisés en deux classes.
1. Les PITP de classe I d'environ 270 résidus sont des PITP à domaine unique et comprennent :
- PITPα, principalement cytosolique,
- PITPβ associé principalement à l'appareil de Golgi pour y maintenir sa composition en PI(4)P, mais aussi au réticulum endoplasmique (RE).
2. Les PITP de classe II sont subdivisés en deux sous-classes.
- Le PITP de classe IIB, i.e. PITPNC1 (RdgBβ), contient un domaine PITP avec une extension C-terminale de 60 ou 80 acides aminés selon les auteurs.
- Les PITP de classe IIA, PITPNM1 et PITPNM2, aussi appelé Nir, i.e. Nir2 et Nir3, une nomenclature basée sur leur liaison au domaine N-terminal de la protéine tyrosine kinase PYK2 (PYK2 N-terminal domain-interacting receptors) sont des grandes protéines qui contiennent des domaines supplémentaires (Emerging perspectives on multidomain phosphatidylinositol transfer proteins 2021).
PITPNM1 s'appelle aussi Nir2/RdgBα.
3. Toutes les PITP peuvent transporter le phosphatidylinositol (PtdIns ou PI), mais :
- la classe I, i.e. PITPα/β, peut transporter aussi la phosphatidylcholine (PC),
- la classe II, l'acide phosphatidique (PA).
Si les activités de liaison et de transfert des lipides des trois PITP solubles, i.e. PITPα, PITPβ et PITPNC1, celles des différents membres de la famille PITP sont exploitées par différents types de cellules pour exécuter de multiples fonctions, qui commencent seulement à être comprises i.e. :
- le trafic de l'appareil de Golgi,
- la phototransduction,
- le détournement de cellules par des virus.
Dans tous ces cas, les phosphoinositides tels que PI(4)P et PI(4,5)P2 ou PIP2 sont les principaux médiateurs.

Les PITP ont pour fonction principale de maintenir les niveaux de phosphoinositides membranaires (The Diverse Functions of Phosphatidylinositol Transfer Proteins 2012).
Structure des PITP
Les PITP font partie de la superfamille STARkin et sont les seuls à pouvoir se lier au phosphatidylinositol (PtdIns ou PI).
Domaine PITP
Structure du domaine PITP
Le domaine PITP peut être subdivisée en quatre régions.
Noyau de liaison lipidique
Le noyau de liaison lipidique est formé par huit brins β en forme une grande feuille concave flanquée de deux longues hélices α, i.e. hélice A et F, qui forment la cavité de liaison lipidique.
1. La liaison au cycle inositol du phosphatidylinositol (PtdIns ou PI) est assurée par 4 résidus d'acides aminés conservés dans la majorité des PITP, i.e. Thr59, Lys61, Glu86 et Asn90, situés sur deux des brins β fournissent les sites de liaison
(Figure : vetopsy.fr d'après Ashlin et coll)
a. Les mutations de l'un de ces résidus individuels entraînent une perte de liaison du PtdIns, mais pas celle de PC dans les PITP de classe I.
b. Quatre autres résidus d'acides aminés conservés, i.e. Gln22, Thr97, Thr114 et Lys195, assurent la la liaison de la fraction phosphodiester du PtdIns ou de PC.
2. La liaison à la phosphatidylcholine (PC) est assurée par Cys95 et Phe225, i.e. résidus sont conservés dans les PITP de classe I mais pas de classe II, qui ne transfèrent pas la PC.
- Cys95 est situé dans la cavité de liaison des lipides et la mutation en thréonine ou en alanine entraîne une perte de liaison et de transfert de PC.
- La mutation de Phe225 en leucine chez l'homme augmente l'activité de transfert de PC, confirmant l'importance de ce résidu pour le transfert de PC.
3. Les résidus impliqués dans la liaison à l'acide phosphatidique (PA) restent à identifier dans les PITP de classe II.
Autres régions
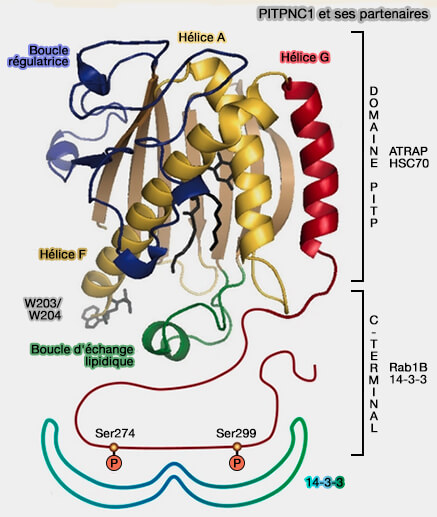
1. L'hélice G C-terminale se terminant par une extension non structurée forme un couvercle qui obstrue la cavité hydrophobe.
- Le groupe de tête du lipide lié, i.e. le cycle inositol est logé profondément à l'intérieur de la cavité et ne peut être atteint par les kinases pour sa phosphorylation, tandis que les chaîne acyle (R-C(=O)-) sn-1 et sn-2 pointent vers le couvercle.
- Le couvercle étant fermé, le phospholipide est complètement enfermé dans la protéine (Dynamics of Lipid Transfer by Phosphatidylinositol Transfer Proteins in Cells 2008)..
2. La boucle d'échange lipidique s'insèrerait dans la bicouche lors de la liaison membranaire (Dynamics and energetics of the mammalian phosphatidylinositol transfer protein phospholipid exchange cycle 2017).
3. La région régulatrice en forme de boucle est supposée être impliquée dans la médiation des interactions protéiques.
Mécanisme
La dynamique du cycle protéique entre " ouvert " et " fermé " est assurée par l'interaction avec une membrane (Dynamics and energetics of the mammalian phosphatidylinositol transfer protein phospholipid exchange cycle 2017 et Molecular insights into conformational dynamics associated with the open- closed-phosphorylated states of PITPα 2017).
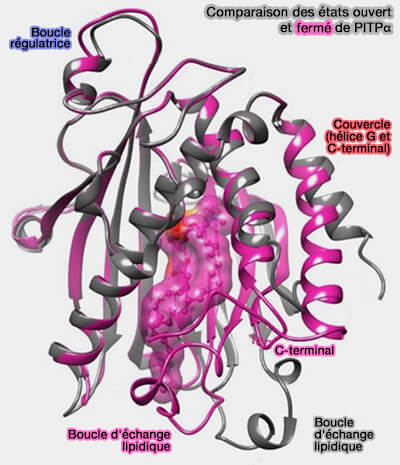
(Figure : vetopsy.fr d'après Ashlin et coll)
1. Dans la structure de la forme sans lipide, la boucle d'échange de lipides et l'hélice G sont inclinées vers l'extérieur de la structure principale, permettant le passage du phospholipide dans ou hors de la cavité.
2. Diverses régions de PITPα ont été identifiées qui participent à l'association membranaire.
- La boucle d'échange lipidique qui s'insère dans la bicouche, illustre un mécanisme souvent employé par les LTP pour améliorer le temps de séjour pendant l'échange de lipides.
- L'hélice G se déplace et se déroule lorsque les PITP sont engagés avec la membrane.
- Deux résidus tryptophane (WW203/204) sont localisés à l'extrémité de la boucle entre un brin β et l'hélice α F, i.e. leur mutation dans PITPβ perturbe la localisation au Golgi, et in vitro, l'activité de transfert lipidique de PITPα et de PITPβ.
Différence avec le domaine START
Le domaine PITP présente quelques différences avec le domaine START.
1. L'entrée de la cavité des PITP est fermé par la combinaison de la boucle d'échange, i.e. boucle Ω1 très développée, et une extrémité C-terminale allongée.
2. L'hélice G près de l'ouverture de la cavité est unique dans la superfamille STARTkin.
Autres domaines
PITP solubles
1. PITPα et PITPβ, qui partagent 77% d'identité de séquence et 95% de similarité de séquence, possède une extrémité C-terminale qui se termine par l'hélice G suivie d'une queue non structurée de 11 acides aminés (The Ligand and membrane-binding behavior of the phosphatidylinositol transfer proteins PITPalpha and PITPbeta 2016).
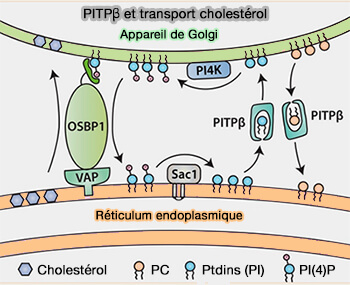
- PITPβ et transport de cholestérol
(Figure : vetopsy.fr d'après Koivuniemi et coll)
PITPβ, hautement enrichi dans le foie, a une plus grande affinité pour la liaison aux membranes et un taux de transfert élevé, est exprimé en deux variants d'épissage aux différences mineures quant à leur activité biochimique (Differential expression of a C-terminal splice variant of phosphatidylinositol transfer protein β lacking the constitutive-phosphorylated Ser262 that localizes to the Golgi compartment 2006) :
- PITPβ-sp1 à 15 acides aminés C-terminaux, Ser262 étant constitutivement phosphorylée,
- PITPβ-sp2 à 16 acides aminés dans lequel Ser262 fait défaut.
2. La protéine de classe IIB, PITPNC1, qui possède un domaine PITP suivi d'une extension C-terminale non structurée de 60 ou 80 acides aminés selon les auteurs, est présente sous deux variants d'épissage, présentent dans le cytosol.
- PITPNC1-sp1 comprend 332 acides aminés et son extension C-terminale contient deux résidus sérine (Ser274 et Ser299) qui forment des sites de liaison pour les protéines 14-3-3 lorsqu'elles sont phosphorylées.
- PITPNC1-sp2 n'a que 269 acides aminés et est aussi présente dans le noyau.
PITPNM1/2 (Nir2/3)
1. Les PITP de classe IIA, PITPNM1 et PITPNM2, aussi appelé Nir, i.e. Nir2 et Nir3, localisées dans le cytosol, partagent une similarité de séquence élevée, et contiennent d'autres domaines en plus du domaine PITP (Emerging perspectives on multidomain phosphatidylinositol transfer proteins 2021).
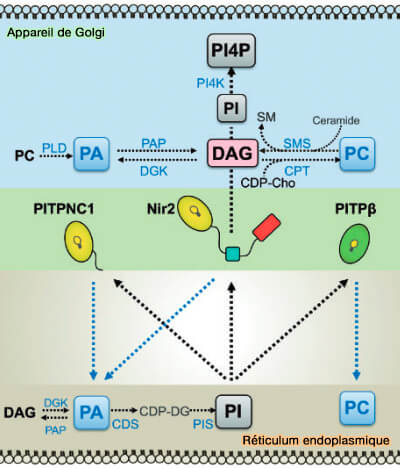
(Figure : vetopsy.fr d'après Cockcroft et coll)
a. Le domaine FFAT se lie aux protéines VAP (VAMP-Associated Protein) du réticulum endoplasmique (RE),
b. Le domaine DDHD de 180 résidus, du nom des quatre résidus conservés, pourrait former un site de liaison au métal similaire à celui observé dans la phospholipase A1 (PLA1), qui jouerait un rôle dans la localisation des protéines :
- à l'appareil de Golgi par sa liaison avec PI(4)P (
MCS RE/Golgi).
- à la membrane plasmique avec PI(4,5)P2 ou PIP2 (
MCS RE/MP)
c. Le domaine LNS2 (Lipin/Nde1/Smp2) C-terminal se lie à l'acide phosphatidique (Interdomain interactions regulate the localization of a lipid transfer protein at ER-PM contact sites 2021).
2. PITPNM1 (Nir2) et PITPNM2 (Nir3) sont présentes dans des tissus différents avec des modèles d'expression et des fonctions cellulaires distinctes. (Emerging perspectives on multidomain phosphatidylinositol transfer proteins 2021).
- Nir2 est ubiquitaire.
- Nir3 est plus abondant dans le système nerveux et est fortement exprimée dans la rétine, en particulier dans les cellules amacrines.

Toutes ces PITP retrouvées dans les MSC RE/Golgi interviennent dans le métabolisme des phosphoinositides avec les PI-kinases et les PI-phosphatases (Mammalian PITPs at the Golgi and ER-Golgi Membrane Contact Sites (2020) et The interface between phosphatidylinositol transfer protein function and phosphoinositide signaling in higher eukaryotes (2019).
Retour aux LTP
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


