Glucides
Glycosylation
: N-Glycosylation
Vue d'ensemble
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La N-glycosylation est la réaction dans laquelle un oligosaccharide est attaché à l'atome d'azote (N) de l'asparagine d'une protéine afin de former un glycoconjugué.
Vue d'ensemble de la N-glycosylation
1. La N-glycosylation est une modification co-traductionnelle, i.e. l'insertion dans la lumière ou la membrane du RE, est concomitante à la synthèse protéique.
a. La O-glycosylation est une modification post-traductionnelle, i.e. elle se déroule après la synthèse de la protéine.
b. Elle a lieu à la fois dans :
- le réticulum endoplasmique (RE), où elle commence,
- l'appareil de Golgi où elle se finit.

(Figure : vetopsy.fr d'après New England Biolabs)
2. La N-glycosylation est la forme la plus répandue des glycosylations et nécessite une liaison glycosidique :
- le groupement réducteur est un hydroxyle ($\ce{-OH}$) de la fonction alcool du carbone anomérique d'un ose, i.e. C1 chez les aldoses et numéro C2 des cétoses.
- le groupement acide est l'hydrogène libre ($\ce{-H}$) d'une autre molécule, dans ce cas, un atome d'azote d'une amide ($\ce{RC(=O)NR′R″}$), i.e. l'asparagine (N).
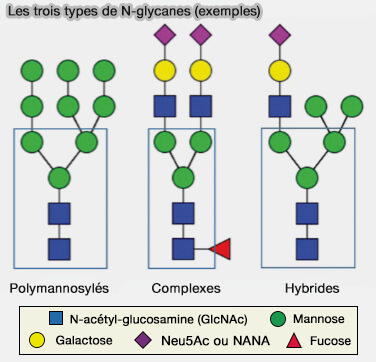
Les trois types de N-glycanes
Les N-glycanes peuvent être rangés en trois types, chaque type construit sur la base $\ce{protéine-L-asparagynyl-(GLcNAc)_2}$$\ce{-}$ comme base.
(Figure : vetopsy.fr)
1. Les N-glycanes (ou oligosaccharides) polymannosylés comportent de nombreux résidus de mannose.
a. Des motifs à 8 mannoses et un glucose comme le glucosyl-mannotriose ou des lectines (calnexine/calcineurine) sont impliqués dans le repliement des glycosylprotéines dans la lumière du réticulum endoplasmique (Les anomalies congénitales de glycosylation des N-glycosylprotéine 2004).
b. Les N-glycanes (ou oligosaccharides) polymannosylés peuvent être phosphorylés comme les récepteurs de mannose-6-P (MPR) à 6 mannoses, dont les 2 derniers portent les P qui sont responsables du ciblage et du trafic des hydrolases lysosomales.
2. Les N-glycanes (ou oligosaccharides) complexes sont ainsi nommés parce qu'ils peuvent contenir presque n'importe quel nombre d'autres types de saccharides.
- La P-sélectine, qui est une lectine impliquée dans la diapédèse des leucocytes, contient du galactose et de l'acide sialique.
- Certains oligosaccharides contenant de multiples acides sialiques sont responsables de la migration neuronale embryonnaire.
3. Les N-glycanes (ou oligosaccharides) hybrides contiennent des résidus de mannose d'un côté de la branche, tandis que de l'autre côté une N-acétylglucosamine (GlcNac) initie une branche complexe.
Fonctions de la N-glycosylation
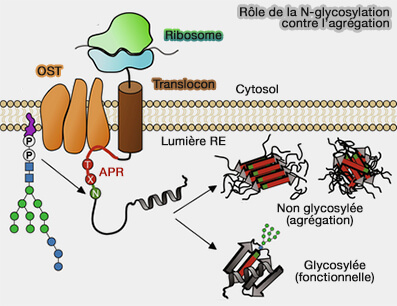
La N-glycosylation a un rôle essentiel dans de nombreuses fonctions.
(Figure : vetopsy.fr d'après Duran-Romaña et coll)
1. Des fonctions sont dites intrinsèques comme :
- la fourniture de composants structurels à la paroi cellulaire et à la matrice extracellulaire,
- la modification des propriétés des protéines, i.e. stabilité et solubilité (Stereoelectronic Effects in Stabilizing Protein–N-Glycan Interactions Revealed by Experiment and Machine Learning 2021),
- la protection contre l'agrégation (N-glycosylation as a eukaryotic protective mechanism against protein aggregation 2024),
- le repliement et le contrôle de qualité de nombreuses glycoprotéines,
- la réparation des membranes.
2. Des fonctions sont dites extrinsèques.
a. La N-glycosylation intervient dans le trafic vésiculaire au sens large (Glycans in autophagy, endocytosis and lysosomal functions (2021).
- Dans les lysosomes, les protéines sont N-glycosylées, et O-glycosylées, comme LAMP1/2 avec 25 sites de glycosylation (50% des protéines lysosomales), et le trafic des hydrolases dépend du mannose-6-phosphate et de ses récepteurs (MPR).
- Dans l'endocytose clathrine-indépendante (CIE), par exemple avec l'aide des lectines et des galectines, dans l'endocytose CLIC/GEEC ou dans la FEME, la glycosylation est essentielle (
tableau des lectines).
- Dans l'autophagie, des protéines sont N-glycosylées comme l'ATG9, ou aident leurs fonctions comme le ganglioside Gd3 qui se colocalise avec les protéines LC3 ou LAMP2A dans la CMA (autophagie médiée par des protéines chaperonnes).
O-GlcNAc transférase ajoute GlcNAc aux protéines et agit comme un signal de stress dans de nombreux processus intracellulaires, comme l'autophagie. En outre, les ligands glycoprotéiques associés à la matrice extracellulaire semblent principalement réprimer l’autophagie.
b. La N-glycosylation joue un rôle dans (The Role of Glycans in Infectious Disease 2022 et N-Glycosylation and Inflammation; the Not-So-Sweet Relation 2023) :
- l'adhérence cellule/cellule et cellule/matrice extracellulaire (
adhérences cellulaires),
- la migration cellulaire, par exemple par les N-glycanes liés à la surface des cellules immunitaires (Glycans In The Immune system and The Altered Glycan Theory of Autoimmunity: A Critical Review 2015),
La N-glycosylation des IgE, IgM, IgD, IgA et IgG leur confère des fonctions effectrices uniques en modifiant leurs affinités pour le complément et d'autres récepteurs immunitaires.
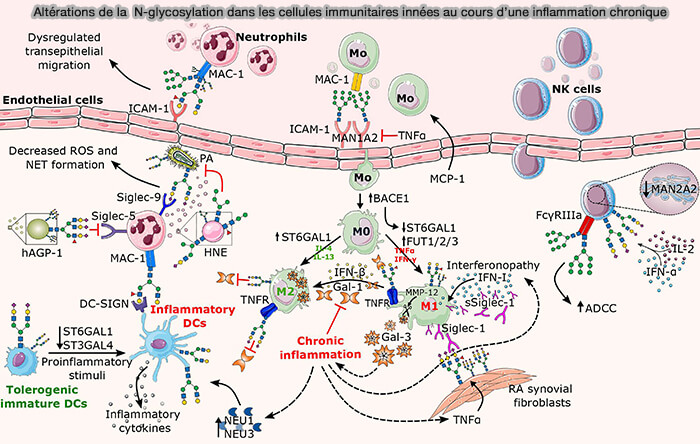
(cellules immunitaires innées)
(Figure : vetopsy.fr d'après Radovani et Gudelj)
3. Les perturbations de la O-glycosylation sont importantes dans de nombreuses maladies, notamment :
- les maladies auto-immunes, comme l'arthrite rhumatoïde,
- le diabète de type 1,
- la maladie de Crohn,
- les cancers.
Mécanisme de la N-glycosylation

Le mécanisme de la N-glycosylation est étudié dans un chapitre spécifique.


