Autophagie
Autophagie médiée par des protéines chaperonnes (CMA)
Vue d'ensemble et protéines impliquées
- Vue d'ensemble du système endomembranaire
- Autophagie
- Système UPS (Système UPS (Ubiquitine-protéasome))
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'autophagie médiée par des protéines chaperonnes (CMA) fait référence à la sélection dépendante des chaperons de protéines cytosoliques solubles qui sont ensuite envoyées vers les membranes lysosomales pour leur dégradation.
L’autophagie est un processus auto-catabolique par lequel des composants cellulaires sont livrés aux lysosomes pour la dégradation et qui comprend trois différents types (
- La macroautophagie, le processus principal, provoque la capture d'une partie du cytoplasme dans un autophagosome qui fusionne ensuite avec un lysosome pour la dégradation du cytoplasme englouti.
- La microautophagie est un processus dans lequel les organites lytiques, i.e. endosomes tardifs (LE), corps multivésiculaires (MVE/MVB) ou lysosomes, absorbent directement une partie du cytoplasme.
- L’autophagie médiée par des protéines chaperonnes (CMA) induit la translocation des substrats cytosoliques vers la lumière lysosomale directement à travers la membrane limitante des lysosomes.

(Figure : vetopsy.fr d'après Kaushik et coll)
Vue d'ensemble de la CMA
L'autophagie médiée par des protéines chaperonnes (CMA) fait référence à la sélection dépendante des chaperons de protéines cytosoliques solubles qui sont ensuite envoyées vers les membranes lysosomales pour leur dégradation.

Vous pouvez lire : The coming of age of chaperone-mediated autophagy (2018) et Diving into the Evolutionary History of HSC70-Linked Selective Autophagy Pathways: Endosomal Microautophagy and Chaperone-Mediated Autophagy (2022).
Dans la CMA, les cargos sont directement incorporés dans la lumière du lysosome en utilisant un complexe de translocation de protéines présent sur sa membrane , sans formation d'autophagosome, i.e. macroautophagie, ou de vésicules, i.e. microautophagie.
Les protéines ciblées sont spécifiques et possèdent un motif de cinq acides aminés de type KFERQ, comme celles de la microautophagie endosomale (eMi).
La CMA ne concerne pas les organites, les autres macromolécules telles que les lipides, les acides nucléiques ou les protéines intégrales membranaires.
Protéines impliquées dans la CMA

(Figure : vetopsy.fr d'après Schnebert et coll
Motif KFERQ
1. Les protéines dégradées par CMA contiennent un motif de cinq acides aminés (KFERQ) qui permet sa reconnaissance par HSC70 (Diving into the Evolutionary History of HSC70-Linked Selective Autophagy Pathways: Endosomal Microautophagy and Chaperone-Mediated Autophagy 2022).
- Ce motif est nécessaire et suffisant pour cibler les protéines pour la dégradation lysosomale.
- Cependant, la séquence exacte, i.e. KFERQ, n’est contenue que dans la RNase A (RNase A ribonucleases and host defense: an evolving story 2008).

(Figure : vetopsy.fr d'après Schnebert et coll)
2. D'une part, les propriétés physiques des résidus constituant le motif, plutôt que les acides aminés spécifiques en soi, déterminent la capacité du chaperon HSC70 à se lier à cette région.
Un motif canonique de type KFERQ, i.e. KFERQ-like, est toujours flanqué d’une glutamine (Q) et doit contenir :
- un ou deux des résidus positifs, i.e. basiques, lysine (K) et arginine (R),
- un ou deux des résidus hydrophobes phénylalanine (F), leucine (L), isoleucine (I) ou valine (V),
- un des résidus chargés négativement, i.e. acides, glutamate (E) ou aspartate (D).
3. D'autre part, des motifs de type KFERQ peuvent être générés par des modifications post-traductionnelles.
Ainsi, la phosphorylation ou l’acétylation des résidus d’acides aminés le long des régions protéiques qui ne présentent pas à l’origine les propriétés mentionnées augmente considérablement le répertoire des substrats présumés de HSC70.
4. Environ 46% des protéines du protéome humain contiennent au moins un motif canonique, 20% ne contiennent pas de motif canonique mais un motif généré par la phosphorylation et 9% ne contiennent que des motifs générés par l'acétylation (Proteome-wide analysis of chaperone-mediated autophagy targeting motifs 2018).
- Ces pourcentages globaux de protéines sont similaires chez Mus musculus, CMA- et eMI-compétent, Drosophila melanogaster, eMI-compétent mais CMA-incompétent, et Saccharomyces cerevisiae (CMA- et eMI-incompétent ?).
- Ces résultats suggèrent que l'émergence du motif KFERQ a probablement précédé l'établissement de la fonction CMA, et peut-être aussi celle de la microautophagie endosomale (eMi).
HSC70/HSPA8
Le chaperon HSC70 (Heat Shok Protein 70)/HSPA8, membre de la famille HSP70, s'exprime principalement de manière constitutive.

La structure de HSC70 et son mécanisme sont étudiés dans un chapitre spécial.
HSC70 ses co-chaperons et ses chaperons coopérants constituent un réseau complexe et est associé à de nombreuses fonctions décisives pour la survie cellulaire, notamment le repliement des protéines et la dégradation des protéines (
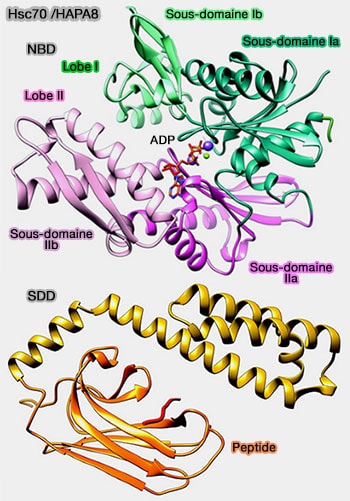
(Figure : vetopsy.fr d'après Stricher et coll)
1. HSC70 reconnait et interagit avec le motif KFERQ spécifique trouvé sur les protéines cibles, facilitant leur translocation (HSPA8/HSC70 in Immune Disorders: A Molecular Rheostat that Adjusts Chaperone-Mediated Autophagy Substrates 2019).
a. Cependant, HSC70 fait partie d'un complexe avec des cochaperons, i.e. HSP90, HSP40, HIP/CHIP/DNABJ1 (HSP70-interacting protein), HOP (HSP70-HSP90 organizing protein).
b. De nombreux activateurs (

Remarque : HSC70 participe aussi à la microphagie endosomale (eMI) et même à la macroautophagie sélective avec les cochaperons de la famille BAG, i.e. BAG1 et BAG3, où elle participe à la dégradation des agrégats protéiques positifs à l’ubiquitine (BAG2 structure, function and involvement in disease 2016).

Une fraction de l'HSC70 cellulaire est constitutivement présente dans les lysosomes, à la fois du côté cytosolique membranaire et de la lumière lysosomale, les deux participant à la CMA.
2. HSC70 est liée à la membrane dans un complexe avec les cochaperons et participe au dépliage du substrat, i.e. processus nécessaire avant la translocation lysosomale.
La membrane HSC70 est également nécessaire pour maintenir les cycles continus de CMA, car, une fois le substrat internalisé, HSC70 facilite la dissociation de la protéine réceptrice du complexe de translocation CMA pour permettre la liaison de nouveaux substrats (The Chaperone-Mediated Autophagy Receptor Organizes in Dynamic Protein Complexes at the Lysosomal Membrane 2008).
3. La deuxième forme de HSC70 lysosomale, localisée dans la lumière, est nécessaire pour compléter la translocation du substrat, i.e. les lysosomes dépourvus de ce chaperon ne peuvent pas effectuer de CMA (An Intralysosomal hsp70 Is Required for a Selective Pathway of Lysosomal Protein Degradation 1997).

(Figure : vetopsy.fr d'après Bonam et coll)
a. La stabilité de HSC70 dans cet environnement acide avec de fortes concentrations de protéases repose sur des propriétés spécifiques de la HSC70 luminale.
Bien que les HSC70 cytosolique et lysosomale proviennent du même gène, la HSC70 luminale a un point isoélectrique très acide, qui est très différent du point isoélectrique neutre du chaperon cytosolique.
b. L'HSC70 luminal devient instable lors de petits changements dans l’acidification lysosomale ce qui permet de réguler le pourcentage de lysosomes compétents pour la CMA à un moment donné.
c. Une question non résolue est de savoir comment HSC70 accède à la lumière lysosomale.
- Le blocage de la macro-autophagie ou CMA ne réduit pas les niveaux de HSC70 luminal qui ne peut donc pas être internalisé par cette voie.
- L’internalisation d'HSC70 à partir du cytosol pourrait se produire dans les endosomes tardifs par le biais de la microautophagie et/ou par la fusion lysosome-endosome.

HSC70/HSPA8 est au centre du triage protéique entre trois types différents d’autophagie chez les mammifères.
LAMP2A
LAMP2A (Lysosomal Associated Membrane Protein 2A) est la seule des trois isoformes, i.e. LAMP2A/B/C d'un seul gène, LAMP2, requise pour le CMA dans laquelle elle intervient à différents niveaux (LAMP2A, LAMP2B and LAMP2C: similar structures, divergent roles 2023).
Les deux autres isoformes possèdent des régions transmembranaires et cytosoliques différentes, mais leur région luminale est identique à LAMP2A (Lysosomal membrane glycoproteins bind cholesterol and contribute to lysosomal cholesterol export 2016).

(Figure : vetopsy.fr d'après Schnebert et coll
LAMP2 est constituée par (Diving into the Evolutionary History of HSC70-Linked Selective Autophagy Pathways: Endosomal Microautophagy and Chaperone-Mediated Autophagy 2022) :
- un domaine C-terminal coiled coil intracellulaire,
- un domaine transmembranaire,
- deux domaines LAMP intralysosomaux, C et N.

(Figure : vetopsy.fr d'après
Schnebert et coll)
1. La queue cytosolique de LAMP2A, i.e. 12 résidus avec le motif canonique GYXXφ, dans lequel φ est un acide aminé hydrophobe, est nécessaire pour l'attache lysosomale des complexes HSC70 (Diving into the Evolutionary History of HSC70-Linked Selective Autophagy Pathways: Endosomal Microautophagy and Chaperone-Mediated Autophagy 2022).
Chez les mammifères, φ est une phénylalanine (F) dont la mutation inhibe la localisation lysosomale.
a. Le HSC70 et le substrat peuvent se lier à cette queue en même temps, suggérant que la reconnaissance et le ciblage du substrat sont des processus couplés.
Le motif KFERQ dans le substrat n'est pas requis pour la liaison LAMP2A.
b. Trois résidus positifs dans la queue cytosolique de LAMP2A sont essentiels pour compléter la CMA des substrats, i.e. le transfert des substrats dépliés nécessite une interaction uniquement avec des résidus chargés négativement.
Le dépliage n'est pas nécessaire pour la liaison de la surface lysosomale, mais est nécessaire pour sa translocation (Import of a Cytosolic Protein into Lysosomes by Chaperone-mediated Autophagy Depends on Its Folding State 2000).
2. LAMP2A doit se multimériser en un complexe protéique de 700 kDa pour la translocation du substrat en lumière lysosomale (Strucure of Transmembrane Domain of Lysosome-associated Membrane Protein Type 2a (LAMP-2A) Reveals Key Features for Substrate Specificity in Chaperone-mediated Autophagy 2016).
a. Le motif GAALAG, situé dans la région transmembranaire de LAMP2A, i.e. 382-387 chez l'homme, est impliqué dans la multimérisation de LAMP2A et, par conséquent, dans la translocation des protéines cibles à l’intérieur des lysosomes.
- La mutation des deux glycines inhibe l'oligomérisation et elles sont conservées chez les mammifères.
- Le domaine LAMP N-terminal pourrait agir comme un régulateur négatif de l'étape de multimérisation entre les protéines LAMP2.
b. La formation d'un homotrimère intermédiaire de LAMP2A augmente l'affinité du substrat et empêche probablement son agrégation au fur et à mesure que le substrat se déplie.
L'HSC70 cytosolique s'associe aux monomères et aux homotrimères de LAMP2A, mais est libérée avant que le complexe de translocation entièrement fonctionnel ne soit assemblé (The Chaperone-Mediated Autophagy Receptor Organizes in Dynamic Protein Complexes at the Lysosomal Membrane 2008).
c. Une forme d'HSP90 associée à la partie luminale de la membrane lysosomale interagit avec et stabilise LAMP2A au cours de cette transition.
HSP90 peut couvrir des zones sensibles à la protéase de LAMP2A qui sont autrement exposées au cours de son agencement conformationnel pour l'ensemble multimérique.
3. L'HSC70 luminal est requis pour la CMA, mais LAMP2A est le composant limitant la vitesse de dégradation du cargo (Molecular evolution of autophagy rate-limiting factor LAMP2 in placental mammals 2020).
- La synthèse de novo de LAMP2A se produit pendant un léger stress oxydatif, une atteinte génotoxique ou une hypoxie, i.e. conditions qui induisent l'activation de la CMA.
- La régulation est encore obscure.
a. La localisation de LAMP2A dans des microdomaines lipidiques de la membrane lysosomale est responsable de sa régulation dynamique (Lysosome membrane lipid microdomains: novel regulators of chaperone-mediated autophagy 2006).
- Dans des conditions de repos, LAMP2A est périodiquement séquestré dans des microdomaines lipidiques pour le clivage par la cathepsine A qui initie sa libération membranaire et sa dégradation rapide dans la lumière.
- Lors de l’activation de la CMA, LAMP2A est activement exclu de ces microdomaines.

(Figure : vetopsy.fr d'après Zhang et coll)
b. Un ciblage défectueux de LAMP2A de l'appareil de Golgi vers les lysosomes est à l’origine de la faible efficacité de la CMA dans la ://, une maladie de surcharge lysosomale (Cystinosin, the small GTPase Rab11, and the Rab7 effector RILP regulate intracellular trafficking of the chaperone-mediated autophagy receptor LAMP2A 2017).
Le trafic de LAMP2A comme mécanisme supplémentaire possible pour réguler l’activité de la CMA.
Mécanisme et rôles de la CMA
Biologie cellulaire et moléculaireConstituants de la celluleSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesAutophagieMacroautophagieMicroautophagieAutophagie chaperonnes (CMA)Autophagie non canoniqueProtéines ATGSystème UPS (Ubiquitine-Protéasome)Transport membranaireTrafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireMoteurs moléculairesVoies de signalisation


