Système endomembranaire
Réticulum endoplasmique (RE)
Stress du RE et UPR
- En construction

L'UPR (Unfolded Protein Response) du réticulum endoplasmique constitue le programme adaptatif activé lorsque la capacité de repliement du RE est dépassée par l’accumulation de protéines immatures.
Vue d'ensemble
1. La réponse UPR du réticulum endoplasmique (RE) détecte ce déséquilibre via ses senseurs transmembranaires et réorganise profondément la protéostasie :
- en modulant la traduction,
- en augmentant la production de chaperonnes,
- en renforçant la filière ERAD.
Cette réponse coordonnée vise à restaurer l’homéostasie du compartiment et à prévenir les conséquences cellulaires du stress protéique prolongé (
2. Cependant, des réponses UPR existent également dans d’autres organites, chacune fondée sur des capteurs, des chaperonnes et des voies de signalisation propres, notamment dans :
- les mitochondries,
- les gouttelettes lipidiques.
UPR du RE
Voies de signalisation
1. Lorsque la quantité de protéines immatures dépasse les capacités du RE, en raison d’une surcharge de synthèse, d’un défaut de maturation, de stress oxydatif ou de dysfonction membranaire, les chaperonnes, en particulier GRP78/BiP, deviennent saturées et se dissocient des senseurs IRE1, PERK et ATF6 (A guide to assessing endoplasmic reticulum homeostasis and stress in mammalian systems 2019).
a. Cette dissociation constitue le signal d’activation des voies UPR, qui orchestrent une réponse intégrée associant :
- augmentation de la capacité de repliement,
- induction des chaperonnes,
- renforcement de l’ERAD,
- inhibition temporaire de la traduction protéique globale,
- remodelage de la protéostasie, i.e. réorganisation coordonnée des capacités de repliement, de dégradation et de gestion des intermédiaires.
b. Chez les mammifères, cette réponse coordonnée stabilise l’homéostasie du réticulum endoplasmique et prévient l’accumulation toxique de protéines mal conformées.
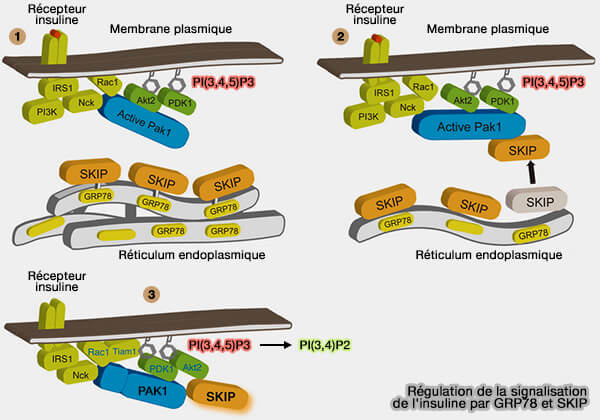
(Figure : vetopsy.fr d'après Ijuin et coll)
2. L’UPR repose sur trois voies de signalisation impliquant des protéines transmembranaires du RE :
- la voie IRE1α (Inositol-Requiring Protein-1 alpha),
- la voie PERK (Protein Kinase RNA (PKR)-like ER Kinase),
- la voie ATF6 (Activating Transcription Factor 6).

Vous pouvez lire, pour une étude plus poussée : Étude de l’expression du stress du réticulum endoplasmique au cours de l’inflammation systémique aiguë chez l’homme (2021).
Mécanisme
1. GRP78/BiP (78 kDa glucose-regulated protein/Binding immunoglobulin protein) est la chaperonne luminale majeure du réticulum endoplasmique et un régulateur central de la protéostasie.
a. Dans les conditions physiologiques, les trois senseurs transmembranaires du réticulum endoplasmique sont maintenus sous une forme inactive par leur association luminale avec GRP78/BiP.
- Elle stabilise les intermédiaires de repliement.
- Elle empêche l’exposition durable de régions hydrophobes.
- Elle maintient les senseurs de l’UPR sous une forme inactive en conditions physiologiques.
b. Lors du stress du RE,, l’accumulation de protéines non repliées mobilise GRP78 vers ces intermédiaires, provoquant sa dissociation des senseurs et permettant leur activation (Roles of Endoplasmic Reticulum Stress in Immune Responses 2018).
Cette dissociation constitue un mécanisme déterminant d’activation, complété par la capacité intrinsèque d’IRE1α et PERK à détecter directement certaines protéines mal conformées.
2. La voie IRE1α repose sur la dimérisation puis l’autophosphorylation du senseur, qui active son domaine endoribonucléase.
- Celui-ci réalise l’épissage non conventionnel de l’ARNm XBP1, générant le facteur de transcription XBP1s.
- Ce dernier induit l’expression de chaperonnes, de composants de l’ERAD et de gènes impliqués dans l’expansion du réticulum endoplasmique, renforçant ainsi la capacité globale de repliement.

(Figure : vetopsy.fr d'après So)
3. La voie PERK s’enclenche par dimérisation et autophosphorylation du senseur, entraînant la phosphorylation du facteur d’initiation eIF2α (Insulin-induced genes INSIG1 and INSIG2 mediate oxysterol-dependent activation of the PERK-eIF2α-ATF4 axis 2021).
- Cette modification réduit globalement la traduction, limitant l’afflux de nouvelles protéines dans le réticulum.
- Elle permet en parallèle la traduction sélective d’ATF4, qui active des gènes impliqués dans l’homéostasie redox, le métabolisme et la survie cellulaire en contexte de stress.
4. La voie ATF6 implique le transport du senseur vers l’appareil de Golgi, où il est clivé par les protéases S1P et S2P.
- Le fragment cytosolique libéré, ATF6(N), agit comme facteur de transcription et induit l’expression de chaperonnes, de composants ERAD et de protéines renforçant le repliement luminal.
- Cette voie module également l’expansion membranaire du réticulum endoplasmique lors de stress prolongé.
Remarque : une voie d'O-GlcNAcylation non spécifique des protéines peut bloquer leur agrégation et leur dégradation protéasomale.
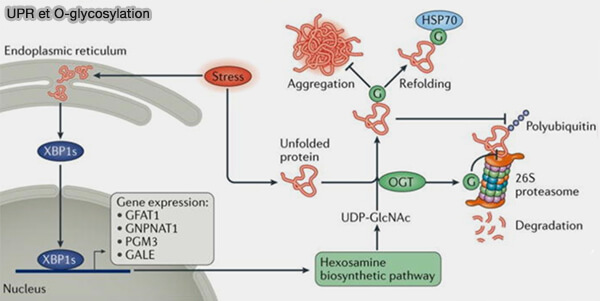
(Figure : vetopsy.fr d'après Yang et Qian)
UPR des mitochondries (UPRmt)
Un contrôle de qualité essentiel se situe au niveau moléculaire, i.e. au niveau des protéines intramitochondriales, et comprend l'induction transcriptionnelle de l'expression des protéines chaperons nécessaires au pliage de ces protéines.

L'UPR mitochondriale est étudiée dans un chapitre spécial.
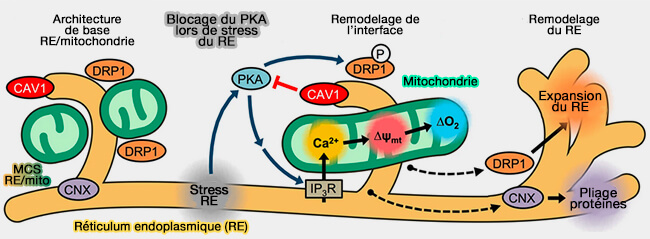
(Figure : vetopsy.fr d'après Bravo-Sagua et coll)
UPR des gouttelettes lipidiques (UPRld)
Les gouttelettes lipidiques (LD ou Lipid Droplets) jouent un rôle déterminant dans la gestion cellulaire du stress protéique et lipidique, en particulier dans les situations où la capacité du réticulum endoplasmique est dépassée (Friend or Foe: Lipid Droplets as Organelles for Protein and Lipid Storage in Cellular Stress Response, Aging and Disease 2020).
Contrairement à l’UPR du RE, fondée sur les senseurs IRE1α, PERK et ATF6, la réponse UPR-LD s’appuie sur la capacité des LD à séquestrer, tamponner et rediriger les protéines et lipides en excès pour préserver la protéostasie.
1. Les LD peuvent servir de réservoir temporaire pour les protéines mal conformées ou partiellement repliées, limitant leur accumulation dans le RE.
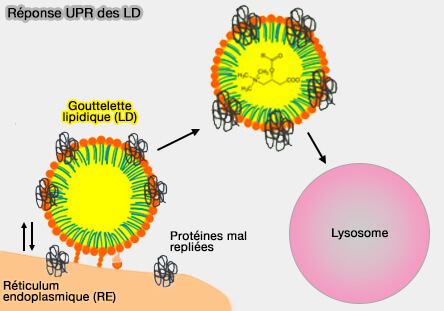
(Figure : vetopsy.fr d'après Geltinger et col)
Au niveau des des MCS LD/RE, certaines protéines anormales dérivées du RE sont transférées vers les LD, où elles sont stabilisées, isolées du milieu luminal et redirigées vers les voies lysosomales ou autophagiques (Protein Quality Control and Lipid Droplet Metabolism 2020).
2. Des protéines spécialisées telles que la seipine, FITM1/FITM2 et les protéines péridroplet associées comme les péripilines, orchestrent l’expansion et la dynamique des LD en réponse au stress lipidique qui vise à :
- augmenter la capacité de stockage des acyl-glycérols, i.e. glycérides.
- prévenir la lipotoxicité induite par les acides gras saturés,
- maintenir l’intégrité des membranes du RE.
3. L’UPR-LD ne remplace pas l’UPR du RE, mais constitue un module parallèle facilitant la gestion des excès de protéines et de lipides lorsque les systèmes de repliement et de dégradation du RE sont saturés.
En agissant comme organites tampons et plates-formes d’orientation vers les voies de dégradation, les LD permettent de soulager temporairement le RE et de limiter l’activation prolongée de la UPR du RE..
Intégration inter-organites
1. Les trois modules, RE, mitochondries et LD, communiquent via :
- des signaux Ca++, par exemple les flux reliant le canal IP3R (Inositol 1,4,5-triphosphate Receptor) du RE et le MCU (Mitochondrial Calcium Uniporter) mitochondrial,
- des signaux lipidiques, tels que le transfert de phosphatidylcholine ou de DAG aux LD ;
- des signaux redox, comme la production mitochondriale de ROS (Reactive Oxygen Species) modulant l’activation d’IRE1α,
- les jonctions RE-mitochondries (MAM), illustrées par les complexes VDAC-IP3R-GRP75 assurant le couplage métabolique.
2. Cette coordination permet :
- la modulation croisée des programmes transcriptionnels,
- l’ajustement de la traduction et de la biogenèse membranaire,
- l’élimination coordonnée des protéines anormales via ERAD, le MAD (mitochondria-associated degradation) ou la lipophagie.
L’ensemble forme une réponse intégrée au stress protéique et lipidique, essentielle à la survie cellulaire dans des conditions de surcharge, de dysfonction organellaire ou de perturbation métabolique.
Retour au repliement des proteines
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


