Transport des lipides
Lipoprotéines : récepteurs
Récepteurs LDLR : LRP4 (Megf7)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

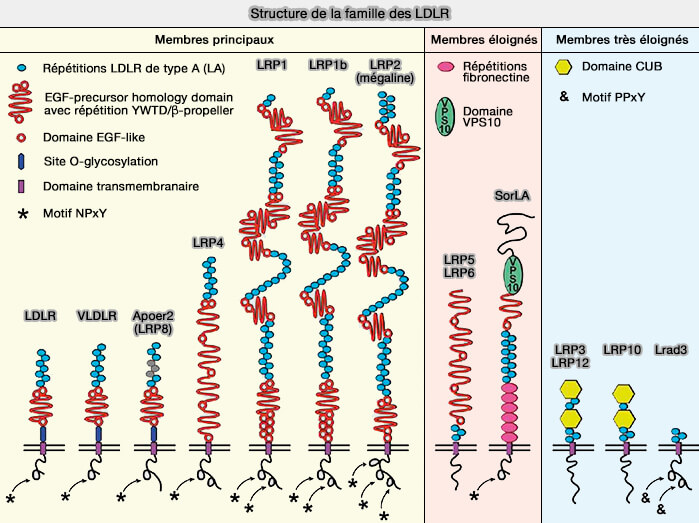
LRP4 (Megf7) est un membre de la famille des LDLR (Low-Density Lipoprotein Receptor) jouant un rôle essentiel dans la transmission de signaux extracellulaires pour initier divers événements intracellulaires au cours du développement.
(Figure : vetopsy.fr d'après Pohlkamp et coll)
LRP4 a été largement étudié pour son rôle dans le développement de la jonction neuromusculaire des mammifères (NMJ), où elle fonctionne comme un récepteur du signal synaptogène agrine pour réguler le développement des synapses (
Toutefois, les études récentes ne cessent de découvrir bien de nouvelles fonctions, en particulier comme organisateur des synapses cérébrales et des troubles du système nerveux.
Structure de LRP4
LRP4 (LDL receptor- related protein 4), appelé aussi MEGF7 (Multiple EGF-like domain 7), découvert en 1998, comporte, comme les autres membres de la famille LDLR, plusieurs domaines (Identification of High-Molecular-Weight Proteins with Multiple EGF-like Motifs by Motif-Trap Screening 1998).
1. La liaison avec les ligands est sous-tendue par :
- 8 LBR sont utilisés pour la liaison du ligand au domaine extracellulaire de la protéine.
- 4 β-propeller.
2. 5 domaines EGF-like, dont un (cbEGF) qui se lie aux ions Ca++ après le domaine final du β-propeller présent chez certains mammifères dont l'homme, sont retrouvés dans le domaine extracytoplasmique
3. Son domaine intracytoplasmique (ICD) partage également des motifs de séquence intracellulaire avec d'autres LRP, y compris un motif NPxY, i.e. importants pour l'endocytose des récepteurs, le trafic et la signalisation intracellulaire et un motif PDZ.
Fonctions de LRP4

Vous pouvez lire : Conservation and Innovation: Versatile Roles for LRP4 in Nervous System Development (2021).
1. LRP4 est essentiel dans la formation et l'organisation des synapses pendant le développement, processus conservé au cours de l'évolution.
La perte de LRP4 chez la souris entraîne la mort par paralysie, probablement causée par un défaut de développement de la jonction neuromusculaire (NMJ), empêchant ainsi la communication entre les motoneurones et les cellules musculaires.
a. LRP4, est un organisateur synaptique, jouant un rôle essentiel dans la transmission de signaux extracellulaires pour initier divers événements intracellulaires.
- Au fur et à mesure que le système nerveux se développe, des connexions entre les neurones doivent se former pour permettre une communication efficace. Ce processus complexe de développement synaptique nécessite la coordination d'une série de mécanismes complexes entre les neurones partenaires pour assurer la différenciation pré- et post-synaptique.
- Bon nombre de ces mécanismes utilisent la signalisation transsynaptique via des facteurs sécrétés essentiels et des récepteurs de surface cellulaire pour favoriser chaque étape du développement synaptique.
- LRP4 fonctionne comme un récepteur pour divers ligands, dont Wnt et l'agrine.
b. LRP4 est impliqué dans le système nerveux pour :
- la formation et le maintien des jonctions neuromusculaires (LRP4 Is Critical for Neuromuscular Junction Maintenance 2014)
- la régénération des nerfs périphériques (The synaptic receptor Lrp4 promotes peripheral nerve regeneration 2018).
- le développement du système nerveux central (Presynaptic LRP4 promotes synapse number and function of excitatory CNS neurons 2017 et Neuronal LRP4 regulates synapse formation in the developing CNS 2017 et The role of agrin, Lrp4 and MuSK during dendritic arborization and synaptogenesis in cultured embryonic CNS neurons 2019),
- la fonction cognitive et la plasticité (Synaptic plasticity and cognitive function are disrupted in the absence of Lrp4 2014 et Lrp4 Domains Differentially Regulate Limb/Brain Development and Synaptic Plasticity 2015),
- la neurogenèse hippocampique adulte, comme LRP6 (Agrin-Lrp4-Ror2 signaling regulates adult hippocampal neurogenesis in mice 2019)
c. En outre, la perte de LRP4 est liée à de multiples maladies neurodégénératives comme :
- la myasthénie grave (Antibodies against low-density lipoprotein receptor–related protein 4 induce myasthenia gravis 2013),
- la sclérose latérale amyotrophique (LRP4 antibodies in serum and CSF from amyotrophic lateral sclerosis patients 2013),
- la maladie d'Alzheimer (A Role of Low-Density Lipoprotein Receptor-Related Protein 4 (LRP4) in Astrocytic Aβ Clearance 2020).
2. LRP4 est impliqué dans un grand nombre de processus autres que neurologiques :
- le développement des membres (Mutations in the gene encoding the low-density lipoprotein receptor LRP4 cause abnormal limb development in the mouse 2006),
- l'organogenèse craniofaciale (Lrp4: a novel modulator of extracellular signaling in craniofacial organogenesis 2010),
- l'ostéogenèse, comme LRP5/6 et apoER2 par la voie de signalisation Wnt (
LRP et métabomisme osseux),
- le développement rénal (LRP4 Mutations Alter Wnt/β-Catenin Signaling and Cause Limb and Kidney Malformations in Cenani-Lenz Syndrome 2010).
3. Tous ces rôles peuvent être considérés sous trois angles non exclusifs, ni exhaustifs :
- LRP4 fonctionne-il de manière pré- ou postsynaptique ?
- LRP4 fonctionne-t-il dans d'une manière dépendante de l'agrine ou indépendante de l'agrine ?
- LRP4 fonctionne-t-il de manière cellulaire autonome ou non cellulaire ?
LRP4/agrine et développement des jonctions neuromusculaires (NMJ)
Le rôle de LRP4 dans le développement des jonctions neuromusculaires (NMJ) est le mieux connu (voir pour les détails : Conservation and Innovation: Versatile Roles for LRP4 in Nervous System Development (2021).
- Avant l'arrivée de l'axone du motoneurone, les nAChR (récepteurs nicotinioques de l'acétylcholine, nitialement répartis de manière diffuse le long du myotube, commencent à se regrouper dans la région centrale du myotube.
- Lorsque le cône de croissance des axones rencontre cette région, un regroupement dense plus étendu des AChR dans la membrane de la plaque terminale postsynaptique, qui est la première étape dans l'élaboration de cette structure en son architecture adulte.

La jonction neuromusculaire est très bien décrite dans tous ses aspects dans : Neuromuscular Junction Formation, Aging, and Disorders 2018) et son développement dans : Dissecting the Extracellular Complexity of Neuromuscular Junction Organizers (2020).
1. LRP4 est essentiel pour la différenciation postsynaptique au niveau des NMJ des mammifères en servant de récepteur à l'agrine (Structural basis of agrin–LRP4–MuSK signaling 2012).
a. L'agrine est un protéoglycane synthétisé dans les motoneurones, transporté le long des axones et qui traverse la fente synaptique avant de se lier au premier β-propeller (β1) de LRP4 postsynaptique.
- Le domaine LG3 (Lamiline-Globular 3) de l'agrine serait le domaine d'interaction minimum avec LRP4.
- Dans les neurones, il contient un insert de huit acides aminés spécifique (ELTNEIPA, appelé Z8) est suffisant pour déclencher l'activation de MuSK et le regroupement des AChR, bien qu'avec une puissance plus faible que l'agrine.
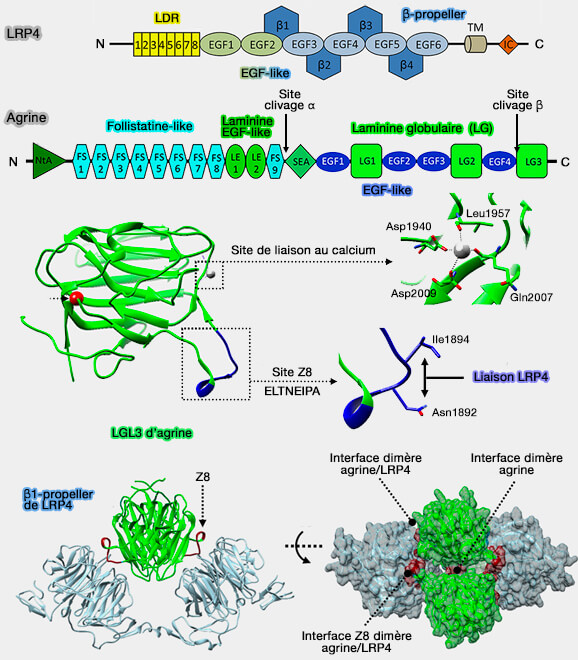
(Figure : vetopsy.fr d'après Guarino et coll)
Remarque : l'agrine pourrait être régulée par prétéolyse, en particulier par la neurotrypsine (Dissecting the Extracellular Complexity of Neuromuscular Junction Organizers 2020).
2. La liaison de l'agrine à LRP4 induit la formation d'un complexe tétramérique, i.e. deux agrines et deux LRP4 qui favorise l'interaction avec le récepteur tyrosine kinase MuSK (Muscle Specific Kinase), ce qui qui provoque :
- sa propre phosphorylation (Structural Mechanisms of the Agrin-LRP4-MuSK Signaling Pathway in Neuromuscular Junction Differentiation 2013),
- sa dimérisation (The Role of MuSK in Synapse Formation and Neuromuscular Disease 2013).
(Figure : vetopsy.fr d'après Guarino et coll)
L'ectodomaine de MuSK possède (Collagen Q and anti-MuSK autoantibody competitively suppress agrin/LRP4/MuSK signaling 2015) :
- trois domaines immunoglobuline-like (Ig1, Ig2 et Ig3),
- un domaine Fz-CRD (Frizzled-like Cysteine-Rich Domain), composé de la boîte C6 portant six cystéines et du quatrième domaine de type Ig (Ig4) contenant quatre cystéines, i.e. les protéines Frizzled sont des récepteurs pour les ligands Wnt (Muscle-Specific Kinase Myasthenia Gravis 2020).
Les domaines Ig1 et Ig4 de MuSK se lieriaient aux 4ème et 5ème répétitions LDLa proches de l'extrémité N-terminale et du troisième domaine β-propeller de LRP4.
Remarque : comme récepteur tyrosine kinase, Musk interagit avec une pléthore de protéines qui régulent son activité ou activent les voies en aval (To build a synapse: signaling pathways in neuromuscular junction assembly 2010).
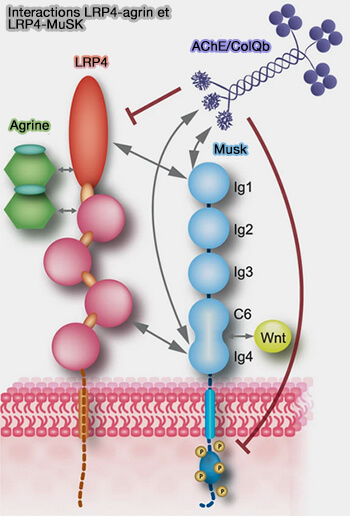
(Figure : vetopsy.fr d'après Otsuka et coll)
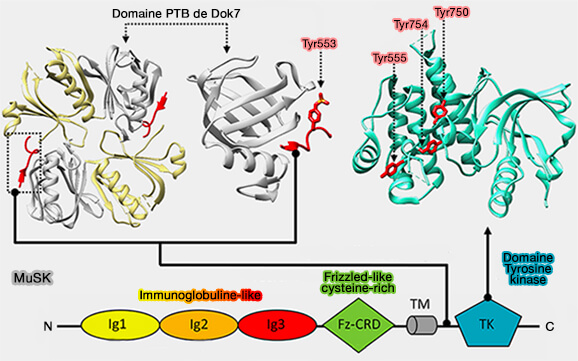
3. L'activation de MuSK nécessite Dok7 (Docking protein 7), une protéine adaptatrice sous forme dimérique elle aussi qui s'exprime sélectivement dans le muscle qui contient :
- un domaine PH (Plecsktrin Homology),,
- un domaine PTB (PhosphoTyrosine-Binding Domain),
- une région C-terminale enrichie de résidus de tyrosine pour une phosphorylation potentielle.
Dok7 est indispensable pour l'activité basale de MuSK et l'activation par l'agrine, i.e. c'est un activateur de la kinase en tant que ligand cytoplasmique.
- En l'absence de Dok7, les synapses neuromusculaires ne se forment pas et les mutations qui altèrent Dok7 sont une cause majeure de myasthénie congénitale chez l'homme.
- La surexpression de Dok7 est suffisante pour activer MuSK, induire des NMJ chez des souris mutantes agrines et leur permettre de survivre pendant des semaines.
Dok7 se lie à Tyr553 de MuSK dans le motif NPxY de la région juxtamembranaire.
- L'autophosphorylation de Tyr553 est essentielle pour l'activation de MuSK (Crystal Structure of the MuSK Tyrosine Kinase: Insights into Receptor Autoregulation 2002).
- Le domaine PTB (PhosphoTyrosine-Binding Domain) se lie directement au Tyr553 phosphorylé, et le domaine PH facilite cette interaction en se liant aux membranes plasmiques contenant PI(4,5)P2 ou PIP2 et PI(3,4,5)P3 ou PIP3 (The Cytoplasmic Adaptor Protein Dok7 Activates the Receptor Tyrosine Kinase MuSK via Dimerization 2010).
- Le domaine PH assure également la médiation de la dimérisation de Dok7, qui dimérise ensuite MuSK pour faciliter l'auto*phosphorylation des tyrosines dans la boucle d'activation de la kinase.
- L'autophosphorylation de la boucle d'activation est nécessaire pour libérer l'autoinhibition et ainsi activer MuSK, i.e. ce processus basal de MuSK est indépendant de l'agrine et peut être induit par des interactions LRP44-MuSK et MuSK-MuSK, qui se produisent toutes deux en l'absence d'agrine.
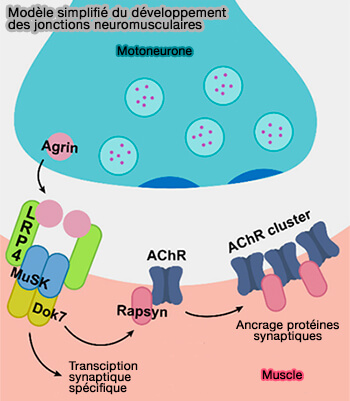
(Figure : vetopsy.fr d'après DePew et Mosca)
4. Dok7 induirait les aspects de la différenciation postsynaptique, i.e. :
- l'ancrage et le regroupement des nAChR (récepteurs nicotinioques de l'acétylcholine), via la phosphortylation de la rapsyne et de la sous-unité β de l'AChR (Identification of a motif in the acetylcholine receptor β subunit whose phosphorylation regulates rapsyn association and postsynaptic receptor localization 2009).
- la transcription de gènes codant pour les protéines synaptiques au niveau des noyaux sous-synaptiques.
5. Des régulateurs supplémentaires de LRP4, notamment Mesdc2 et CTGF favorisent la fonction de LRP4.
a. Mesdc2 (mesoderm development candidate 2) se lie à la forme intracellulaire de LRP4 et favorise sa glycosylation, i.e. augmente son expression à la surface cellulaire (Mesdc2 plays a key role in cell-surface expression of Lrp4and postsynaptic specialization in myotube 2013).
- L'inactivation de Mesdc2 supprime l'expression à la surface cellulaire de LRP4, l'activation de MuSK et la spécialisation post-synaptique dans les cellules musculaires.
- Ces résultats suggèrent que Mesdc2 joue un rôle essentiel dans la formation de NMJ en favorisant la maturation de Lrp4.
b. CTGF/CCN2 (Connective Tissue Growth Factor), en se liant directement au troisième β-propeller de LRP4, améliore la liaison de LRP4 à MuSK, la phosphorylation de Musk par l'agrine et facilite la localisation de LRP4 sur la membrane plasmique (CTGF/CCN2 facilitates LRP4-mediated formation of the embryonic neuromuscular junction 2020).
Remarque : cette fonction de LRP4 peut être classée comme postsynaptique, dépendante de l'agrine et cellulaire autonome.

La complexité du regroupement des AChR par la voie de signalisation de l'agrine peur être résumée dans cette figure non exhaustive tirée de : To build a synapse: signaling pathways in neuromuscular junction assembly (2010).
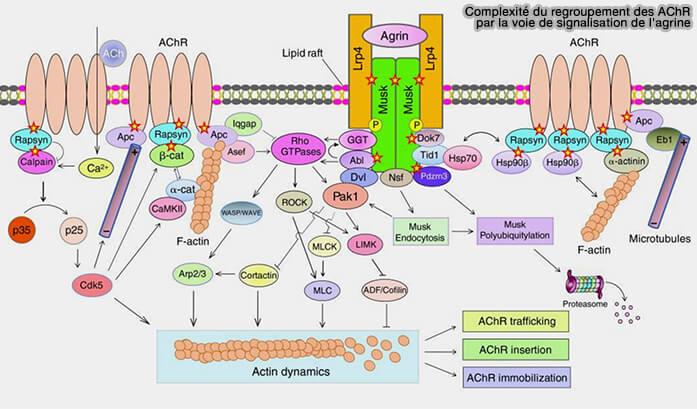
(Figure : vetopsy.fr d'après Wu et coll)
Se basant sur son rôle princeps dans les jonctions neuromusculaires (NMJ), LRP4 a des rôles supplémentaires dans d'autres mécanismes antérieurs à la différenciation post-synaptique du NMJ.
LRP4 et système nerveux périphérique
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasPhospholipidesPhosphoinositidesCholestérolAcides biliairesGlycéridesDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesTrafic des lipoprotéinesRécepteurs des lipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


