Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Biogenèse
FIT/FITM (Fat storage-Inducing Transmembrane Protein)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les FIT (Fat storage-Inducing Transmembrane Protein) ou FITM, i.e. FIT1 et FIT2, sont des protéines du réticulum endoplasmique (RE) à multiples domaines transmembranaires qui sont liées à la nucléation et au bourgeonnement des gouttelettes lipidiques (LD).
Vue d'ensemble des FIT
Les FIT (Fat storage-Inducing Transmembrane Protein ou FITM), i.e. FIT1 et FIT2 humaines, sont des protéines du réticulum endoplasmique (RE) à six domaines transmembranaires avec leurs extrémités N- et C-terminales cytosoliques qui semblent être liées à la formation et au bourgeonnement des LD (A conserved family of proteins facilitates nascent lipid droplet budding from the ER 2015).
Scs3 et Yft2 sont leurs homologues chez la levure.

Vous pouvez lire : Fat storage-inducing transmembrane proteins: beyond mediating lipid droplet formation (2022). Toutefois, il faut bien comprendre que leurs rôles sont encore obscurs et les maladies métaboliques qui leur sont imputées sont encore hypothétiques.
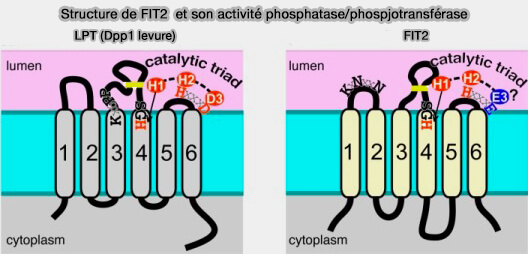
(Figure : vetopsy.fr d'après Hayes et coll)
1. FIT2 apparaît sur les sites de formation de LD et précèdent l'apparition des LiveDrop puncta, ce qui implique qu'une activité localisée est nécessaire à un stade précoce de la formation naissante des gouttelettes lipidiques (FIT2 organizes lipid droplet biogenesis with ER tubule-forming proteins and septins 2021).
2. L'épuisement des FIT dans les cellules inhibe le bourgeonnement des gouttelettes lipidiques (LD)., entraînant l'accumulation de petites lentilles lipidiques neutres intégrées dans la membrane du RE (Postnatal Deletion of Fat Storage-inducing Transmembrane Protein 2 (FIT2/FITM2) Causes Lethal Enteropathy 2015).
a. FIT2 se lierait directement aux lipides neutres sans savoir comment et serait impliqué dans leur partition dans le RE pour la nucléation des LD (Direct binding of triglyceride to fat storage-inducing transmembrane proteins 1 and 2 is important for lipid droplet formation 2011).
FIT1 se lierait plus faiblement aux TG et aux diglycérides (DAG) que FIT2, ce qui entraînait des LD plus petites.
b. Toutefois, la seipine serait capable de regrouper les molécules de triglycérides (TG), puis de générer des sites RE avec une composition lipidique spécifique qui, à son tour, recruteraient les FIT et des périlipines(Seipin accumulates and traps diacylglycerols and triglycerides in its ring-like structure 2021).
Ces deux études indiquent que les protéines FIT interviennent aussi dans l’étape de nucléation et au bourgeonnement des gouttelettes lipidiques.
Fonctions des FIT
FIT2 est une acyl-CoA diphosphatase, pour l'instant la seule acyl-CoA hydrolase (EC 3.1.2.20) dans la lumière du RE, dont le site actif se trouverait du côté luminal de la membrane.
1. Cette activité enzymatique serait sélective sur l'acide phosphatidique (PA) et lysophosphatidique (FIT or FITM) proteins are related to lipid phosphatase/phosphotransferase enzymes 2017).
$\ce{PA/lysoPA-CoA + H2O}$ $\rightarrow$ $\ce{PA/lysoPA + CoA + H+}$
2. Le clivage de la liaison phosphoanhydride (ou pyrophosphate) de l'acyl-CoA pourrait être couplée à des changements conformationnels induisant le pompage actif de lipides neutres à travers la membrane (Fat storage-inducing transmembrane (FIT or FITM) proteins are related to lipid phosphatase/phosphotransferase enzymes 2018).
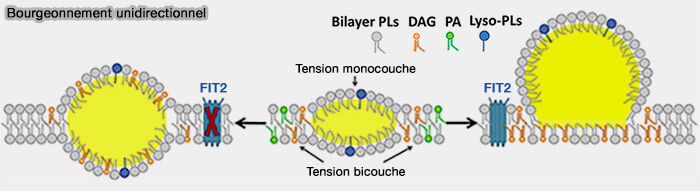
(Figure : vetopsy.fr d'après Gao et coll)
a. Cette activité réduirait les niveaux de phospholipides (PL) au niveau du feuillet cytosolique et augmenterait ceux de diglycérides (DAG) afin de faciliter le bourgeonnement (
- FIT2 induirait une tension plus élevée de la couche luminale par rapport à celle de de la couche cytoplasmique en consommant du DAG du côté cytoplasmique et/ou en produisant du diglycéride (DAG) du côté de la lumière (figure ci-dessus à droite).
- En l'absence de FIT2, plus de DAG est présent du côté cytoplasmique et/ou moins de DAG s'accumule du côté de la lumière, abolissant l'asymétrie de tension monocouche et provoquant l'inclusion des LD dans les deux feuillets du RE (figure ci-dessus à gauche).
b. FIT2 interviendrait plus généralement sur l'homéostasie du RE pour maintenir usa morphologie en évitant l'accumulation d'acyl-CoA qui conduit à une dysfonction cellulaire I(FIT2 is an acyl–coenzyme A diphosphatase crucial for endoplasmic reticulum homeostasis 2021).
3. L’opinion dominante est que les FIT ne sont pas impliqués dans la synthèse des triglécérides (TG), bien que certains pensent le contraire, mais jouent un rôle important dans la formation des LD (
- FITM pourrait s'associer à des domaines impliqués à la fois dans la synthèse des TG et dans la biogenèse naissante des LD, et potentiellement améliorer la coordination générale de la synthèse des lipides neutres et de la formation des LD.
- Néanmoins, le rôle coordinateur de la famille FIT dans la synthèse des lipides neutres et la formation de LD nécessite des recherches plus approfondies.
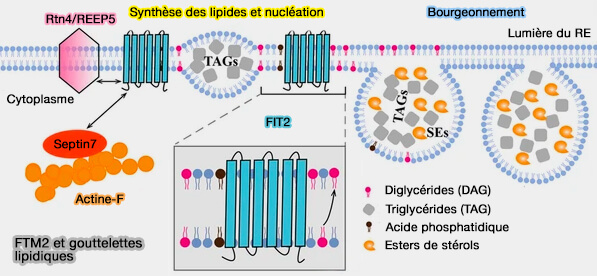
(Figure : vetopsy.fr d'après Wang et coll)
Interactions des FIT
FIT2 peut se lier à la septine 7, protéine cytosquelettique, et interagir avec les protéines formant des tubules du RE, Rtn4 et REEP5 (FIT2 organizes lipid droplet biogenesis with ER tubule-forming proteins and septins 2021).
Les sites de contact membranaire (MCS) entre les LD et d'autres organites jouent un rôle important dans l'échange de métabolites (
- La déstabilisation de l'actine affecte la taille et la composition lipidique des LD des macrophages et dissocie des LD des peroxysomes.
- Les anomalies des microtubules réduisent le nombre de contact entre les LD et ses principaux organites partenaires et diminue la lipophagie.
REEP5 et Rtn4
1. FIT2, mais aussi REEP5 ou Rtn4 apparaissent à un stade précoce de la formation naissante de LD, ce qui pourrait expliquer pourquoi la surexpression de FIT2 seule ne stimule pas la formation de LD.
a. La colocalisation de FIT2, des protéines formant des tubules du RE et LiveDrop implique un contrôle spatial de la formation de LD dans les sous-domaines du RE.
b. Les interactions entre FIT2 et les protéines formant des tubules peuvent être classées en deux types.
- REEP5 engage principalement la moitié N-terminale de FIT2.
- Rtn4 se lie aux deux moitiés.
2. Les protéines formant des tubules provoquent la courbure de la membrane (Membrane Curvature Catalyzes Lipid Droplet Assembly 2020).
- La courbure intrinsèque des phospholipides dans le RE est essentielle pour l'architecture des LD (Architecture of Lipid Droplets in Endoplasmic Reticulum Is Determined by Phospholipid Intrinsic Curvature 2018).
- FIT2 concentré au site de bourgeonnement pourrait générer une courbure supplémentaire, dans ce cas par des protéines membranaires intégrales, à la naissance des LD.
Septines
L'épuisement des septines retarde la formation des LD.
1. Le domaine GTPase de la septine 7 pourrait entrer en contact direct avec les deux boucles cytosoliques de FIT2.
L'implication de la septine dans la biogenèse de la LD a été proposée, mais sous forme de régulation indirecte via les microtubules (Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV 2016).
2. D'autres septines sont connues pour interagir avec les phospholipides (PL) via une hélice amphipathique C-terminale.
Les septines ancrées à FIT2 pourraient retenir les phospholipides de surface des LD nouvellement formées.
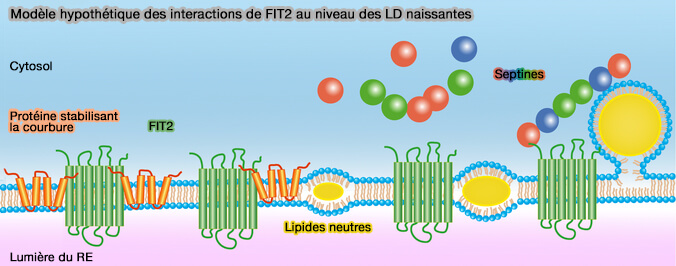
(Figure : vetopsy.fr d'après Chen et coll)
3. En outre, de tels échafaudages stabiliseraient non seulement les LD naissantes, mais assureraient également un bourgeonnement directionnel vers le cytoplasme du compartiment membranaire enrichi en lipides neutres.

En conséquence, les interactions du cytosquelette jouent également un rôle dans le processus de formation des gouttelettes lipidiques à un stade précoce.
- Les lipides neutres dans les deux feuillets des membranes du RE peuvent s'accumuler avec FIT2, qui recrute des protéines formant les tubules du RE pour stabiliser la courbure de la lentille huileuse en croissance ou favoriser la préparation des lipides.
- Le renflement vers l’extérieur de la lentille d’huile peut être davantage soutenu par des septines interagissant avec FIT2.
Retour à la nucléation ou au bourgeonnement des LD
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


