Cofacteurs
Coenzymes de transfert
Acyl-coenzyme A (acyl-CoA)
: synthèse et classification
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les acyl-CoA représentent les formes activées d'acides, et en particulier d'acides gras, qui, libres, ne pourraient être métabolisés.
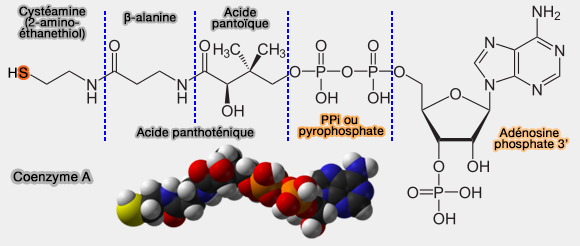
La coenzyme A est capable de s'unir à de nombreux dérivés carboxyliques par formation d'une liaison thioester ($\ce{R–S–CO–R'$}), liaison " riche en énergie ".
$\ce{R-COOH + HSCoA}$ $\leftrightharpoons$ $\ce{R-CO-S-CoA + H2O}$
(Figure : vetopsy.fr)
Synthèse des acyl-CoA
La synthèse d'un acyl-CoA exige un apport énergétique, fourni par l'ATP, car la liaison thioester ($\ce{R–S–CO–R'$}) est " riche en énergie ".
Remarque : un groupe acyle ($\ce{-C(=O)-}$) est un groupe dérivé d’un acide carboxylique ($\ce{R-C(=O)OH}$ par perte du groupes hydroxyle ($\ce{OH}$).
La synthèse des acyl-CoA nécessite des acylCoA synthétases (ou thiokinases), classées sous EC 6.2, qui sont réprésentées par plus d'une cinquantaine de membres qui diffèrent selon (
- la longueur des acides gras transportés,
- selon les nucléotides produits, AMP ou ADP.

Nous prendrons comme exemple l'acyl-CoA synthétase des acides gras à longue chaîne (Long-chain-fatty-acid-CoA ligase), i.e. EC 6.2.1.3.
Mécanisme général
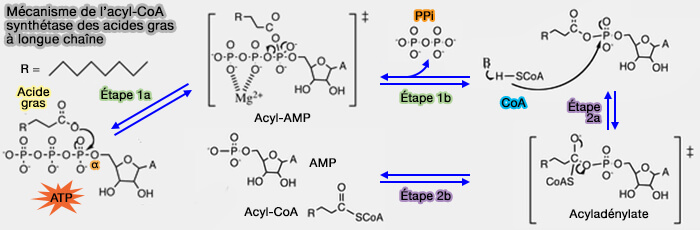
1. Cette réaction est catalysée en deux étapes, par exemple pour l'activation d’un acide gras en acyl-CoA, étape clé avant qu’il entre dans la β-oxydation.
(Figure : vetopsy.fr)
La réaction globale est la suivante :
$\ce{R-(C=O)OH + CoASH + ATP}$ $\leftrightharpoons$
$\ce{R-(C=O)S-COA + AMP + PPi}$
2. Cette réaction est théoriquement réversible sur le plan thermodynamique, mais pratiquement irréversible dans la cellule.
En effet, elle est fortement exergonique, i.e. $\Delta G_0'$ de cette réaction globale est fortement négatif, i.e. ≈ -45 à -50 kJ/mol., grâce à l’hydrolyse pratiquement du pyrophosphate PPi en 2 Pi.
3. Le mécanisme de la synthèse de l’acyl-CoA synthétase grasse à longue chaîne est un mécanisme de " bi uni uni bi ping-pong " dans lequel [Structural Basis of the Substrate-specific Two-step Catalysis of Long Chain Fatty Acyl-CoA Synthetase Dimer 2004) :
- bi, 2 substrats se lient en premier, i.e. acide gras et ATP,
- uni, 1 produit sort, i.e. PPi,
- uni, 1 substrat entre, i.e. CoA,
- bi, 2 produits sortent, i.e. AMP et acyl-CoA,
- ping-pong, changement de l'état de l'enzyme entre deux étapes, i.e. le produit est libéré avant qu’un autre substrat ne puisse se lier à l’enzyme.
Première étape
La première étape comprend deux phases de réaction globale :
$\ce{R-(C=O)OH + ATP + Enz}$ $\leftrightharpoons$ $\ce{Enz-R-(C=O)-AMP + PPi}$
1a. Dans la première phase, l’ATP et un acide gras à longue chaîne pénètrent dans le site actif de l’enzyme (bi) qui est modifié (ping).
- À l’intérieur du site actif, l'oxygène du groupe carboxyle ($\ce{-COO-}$ de l’acide gras, nucléophile, attaque le phosphate α de l’ATP, conduisant à la formation d'un intermédiaire activé d’acide gras, i.e. acyl-AMP (
attaque nucléophile).
- Le produit acyl-AMP. formé lors de la première étape possède une énergie libre d'hydrolyse élevée, car il conserve une grande partie de l'énergie issue de la rupture de la liaison phosphoanhydride de l'ATP stockée dans la liaison anhydride mixte entre l'acide gras et l'AMP.
b. Dans la deuxième phase, le pyrophosphate (PPi) s’échappe (uni), ce qui donne une molécule d’acide gras à longue chaîne AMP dans le site actif de l’enzyme.
Le pyrophosphate (PPi), formé en tant que sous-produit, est ensuite rapidement hydrolysé par une pyrophosphatase, ce qui rend la réaction thermodynamiquement irréversible.
(Figure : vetopsy.fr)
Deuxième étape
La deuxième étape comprend deux phases de réaction globale :
$\ce{Enz-R-(C=O)-AMP + CoASH}$ $\leftrightharpoons$ $\ce{Enz + R-(C=O)S-COA + AMP}$
2a. Dans la première phase, la coenzyme A pénètre maintenant dans l’enzyme (uni) et un autre intermédiaire est formé, qui se compose de l’acide gras à longue chaîne AMP-coenzyme A, i.e. acyladénylate.
2b. Dans la deuxième phase, deux produits sont libérés, l’AMP et le produit Acyl-CoA (bi), et l’enzyme revient à son état initial (pong).
La deuxième étape, le transfert du groupe acyle au CoA, forme une liaison thioester riche en énergie dans l'acyl-CoA.
- Cette nouvelle liaison conserve l’énergie libre présente dans l’intermédiaire acyl-AMP car la liaison anhydride mixte (acyl-AMP) et la liaison thioester (acyl-CoA) sont très proches en termes d’énergie libre d’hydrolyse ( $\Delta G_0'$ ~-30 à -35 kJ/mol).
- Par conséquent, la variation d’énergie libre standard de cette étape est proche de zéro, car il s’agit d’un échange entre deux liaisons à haute énergie.
3. La réaction évolue dans le sens de la synthèse de l'acyl-CoA car deux liaisons " riches en énergie " sont utilisées :
- l`hydrolyse de l'ATP en AMP, qui fournit environ -30 KJ mole-1,
- l'hydrolyse du pyrophosphate (PPi) en 2 PPi, qui fournit environ −19 KJ mole-1.
Classification des acylCoA synthétases (ou thiokinases)
On trouve plus d'une cinquantaine d'acylCoA synthétases (ou thiokinases), classées sous EC 6.2 (Evidence for 26 distinct acyl-coenzyme A synthetase genes in the human genome 2007).
Ces enzymes peuvent être classées selon :
- la longueur des acides gras transportés,

Une liste des acylCoA synthétases selon la longueur des acides gras est disponible sur Wikipedia,
- selon les nucléotides produits, AMP ou ADP.
1. Les AMP-forming acyl-CoA synthétases (EC 6.2.1), les plus courantes, sont surtout utilisées pour :
- l'activation des acides gras pour la β-oxydation, comme l'acyl-CoA synthétase longue chaîne, vue plus haut,
- la synthèse des acétyl-CoA, propionyl-CoA…
Par exemple, la butyrate-CoA ligase, EC 6.2.1.2 :
$\ce{Butyrate+ CoA + ATP}$ $\leftrightharpoons$ $\ce{Butyryl-CoA + AMP + PPi}$
2. Les ADP-forming acyl-CoA synthétases (EC 6.2.2) sont moins fréquentes, mais importantes.
a. Par exemple, dans l'étape 7 du cycle de Krebs, la formation du succinate à partir du succinyl-CoA
$\ce{Succinate + CoA + ATP}$ $\leftrightharpoons$ $\ce{succinyl-CoA + ADP + phosphate}$
$\ce{Succinate + CoA + GTP}$ $\leftrightharpoons$ $\ce{succinyl-CoA + GDP + phosphate}$
b. on peut citer aussi, chez les procaryotes :
- la citrate-CoA ligase, EC 6.2.1.1, ou la malate-CoA ligase, EC 6.2.1.13,
- l'acétate-CoA ligase (ADP-forming), EC 6.2.1.13, alternative moins fréquente à l'AMP forming,
- moins coûteuse en énergie car une seule liaison phosphoanhydride de l’ATP est hydrolysée,
- adaptée aux environnements où l’ATP est limité, comme lors d'hypoxie et de fermentation…
- réversible contrairement à l'AMP forming .
$\ce{Acétate + CoA + ATP}$ $\leftrightharpoons$ $\ce{acétyl-CoA + ADP + Pi}$
Transport et rôles des acyl-CoA
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


