Enzymes
Groupe des transférases (EC 2)
Lipides kinases
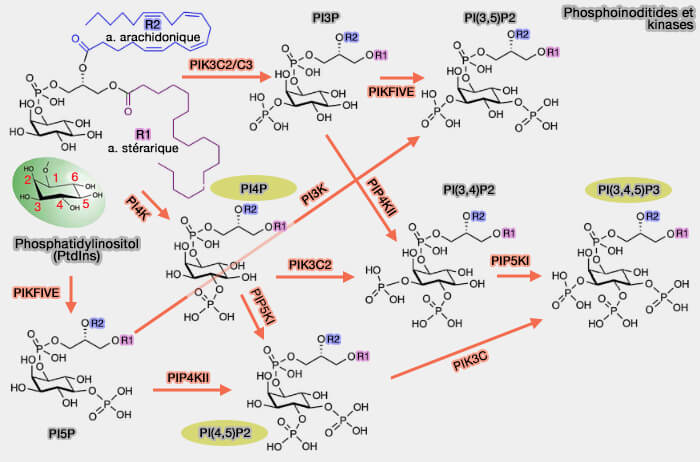
Phosphatidylinositol kinases (PI kinases)
Phosphatidylinositol 3-kinases (PI3K) : PI3KC
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les PI3KC sont une classe de PI3K, phosphatidylinositol kinases (PIK ou PI-Kinases) capables de phosphoryler le groupe hydroxyle en position 3 du cycle inositol des phosphoinositides.
Les autres classes de PI3K diffèrent par leur spécificité de substrat et génèrent donc des espèces de phosphoinositides distinctes.
- Les PI3K de classe II synthétisent PI(3,4)P2 et, dans une moindre mesure, PI(3)P.
- Les PI3K de classe III synthétisent PI(3)P, la seule classe conservée depuis la levure jusqu'à l'homme.

Vous pouvez lire : Classes of phosphoinositide 3-kinases at a glance (2014) et Synergy in activating class I PI3Ks (2015)
(Figure : vetopsy.fr)
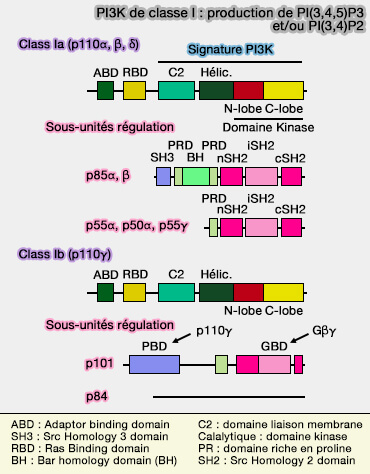
PI3K de classe I : PI3KC
Les PI3K de classe I (EC 2.7.1.153) ont comme substrat spécifique PI(4,5)P2 ou PIP2 pour le phosphoryler en PI(3,4,5)P3 ou PIP3.
$\ce{ATP + PI(4,5)P2}$ $\leftrightharpoons$ $\ce{ADP + PI(3,4,5)P3}$
(Figure : vetopsy.fr)
Les PI3K sont divisées en :
- PI3K de classe Ia,
- PI3K de classe Ib.
PI3KC de classe a
1. La classe Ia comprend trois PI3K qui partagent les sous-unités polypeptidiques catalytiques homologues p110 (Rationale-based therapeutic combinations with PI3K inhibitors in cancer treatment 2015) :
- PIK3CA (p110α) et PIK3CB (p110β) sont présentes dans toutes les cellules
- PIK3CD (p110δ) est retrouvée en grande quantité dans les leucocytes, i.e. comme p110γ de la classe b.
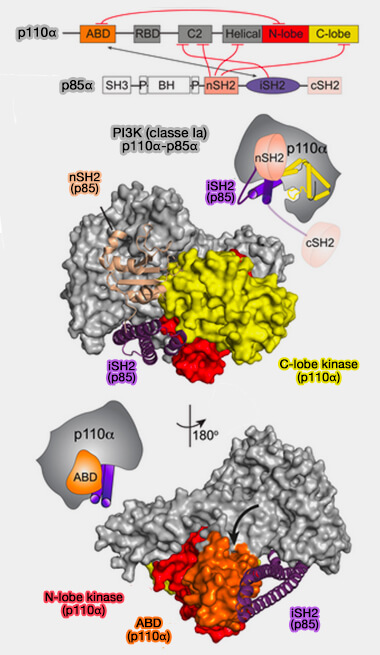
2. Les PI3K de classe Ia, protéines multidomaines, sont des complexes protéiques hétérodimères constitués des sous-unités catalytiques (p110) et régulatrices (p85).
Sous-unité catalytique (p110α, β et δ)
La sous-unité catalytique (p110) comprend plusieurs domaines (Molecular mechanism of activation of class IA phosphoinositide 3-kinases (PI3Ks) by membrane-localized HRas et Structure of the phosphoinositide 3-kinase p110γ-p101 complex reveals molecular mechanism of GPCR activation 2021).
1. Le domaine N-terminal (ABD ou Adaptator Binding Domain) interagit avec la sous-unité régulatrice (p85), i.e. le terme BD est domaine de liaison (Binding Domain) qui s'applique à plusieurs domaines.
La boîte basique N-terminale (KKKK dans p110α) permet la liaison au 5′-phosphate.
2. Le domaine RBD (Ras-BD) de p110α, p110δ et p110γ sont des effecteurs des petites GTPases Ras Ras dépendant du stimulus (KRAS interaction with RAF1 RAS-binding domain and cysteine-rich domain provides insights into RAS-mediated RAF activation 2021).
(Figure : vetopsy.fr d'après Rathinaswamy et coll)
3. Le domaine C2 se lie à la membrane.
4. Le domaine hélicoïdal a un rôle inconnu.
5. Le domaine C-terminal catalytique est responsable de l'activité enzymatique.
La boîte C-terminale (motif KRER dans p110α) s'associer au 4′-phosphate de PI(4,5)P2 ou PIP2.
Sous-unités régulatrices
1. Il existe plusieurs sous-unités régulatrices (Structural Basis for activation and inhibition of class i Phosphoinositide 3-Kinases 2011):
- p85α et ses variants d'épissage p55α and p50α,
- p85β,
- p55γ.
2. La sous-unité régulatrice (p85) comprend :
- un domaine SH3 (SRC Homology 3), qui peut, concomitamment avec le domaine BH, se lier à la phosphatase PTEN, avec le
- deux domaines PRD (Proline-Rich) entourant le domaine BH,
- un domaine BH (BcR Homology), qui régule l'activité de plusieurs petites GTPases, en particulier de Rab5 dans les endosomes précoces,
- deux domaines SH2 (SRC Homology 2), nSH2, i.e. N-terminal, et cSH2, i.e. C-terminal, qui se lient aux résidus tyrosine phosphorylés des récepteurs tyrosine kinases (RTK),
- un domaine iSH2 (inter-SH2), comme son nom l'indique entre les deux domaines SH2, qui interagit et inhibe la sous-unité p110.
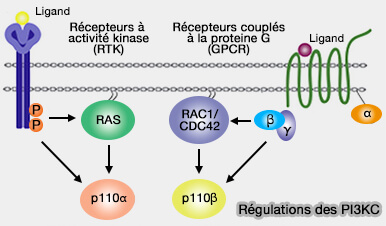
2. De nombreux ligands, comme les cytokines ou les facteurs de croissance, peuvent se lier aux récepteurs tyrosine kinases (RTK) en provoquant la dimérisation du récepteur et la phosphorylation croisée des résidus tyrosine des domaines intracellulaires.
(Figure : vetopsy.fr d'après Fritsch et coll)
Les domaines SH2 de p85 reconnaissent les sites phosphorylés et libèrent l'inhibition du domaine iSH2 sur la sous-unité catalytique p110.
- p110 peut alors phosphoryler le PI(4,5)P2 ou PIP2, abondant dans la membrane plasmique interne pour produire du PI(3,4,5)P3 ou PIP3.
- PIP3 déclenche la signalisation en aval.
p110 peut être recruté indépendamment de p85, comme par la Ras-GTP, voire d'autres molécules comme substrat du récepteur de l'insuline (IRS).
Cette réaction peut être est inversée :
- soit par la PI 3-phosphatase PTEN (Phosphatase and TENsin homolog), qui reproduit le PI(4,5)P2 ou PIP2.
- soit par la PI 5-phosphatase SHIP (SH2 domain-containing Inositol 5'-Phosphatase), qui produit le PI(3,4)P2.
(Figure : vetopsy.fr d'après creative-diagnostic.com)
PI(3,4,5)P3 ou PIP3 et PI(3,4)P2 régulent la fonction de plusieurs effecteurs en aval en les recrutant dans la membrane plasmique comme :
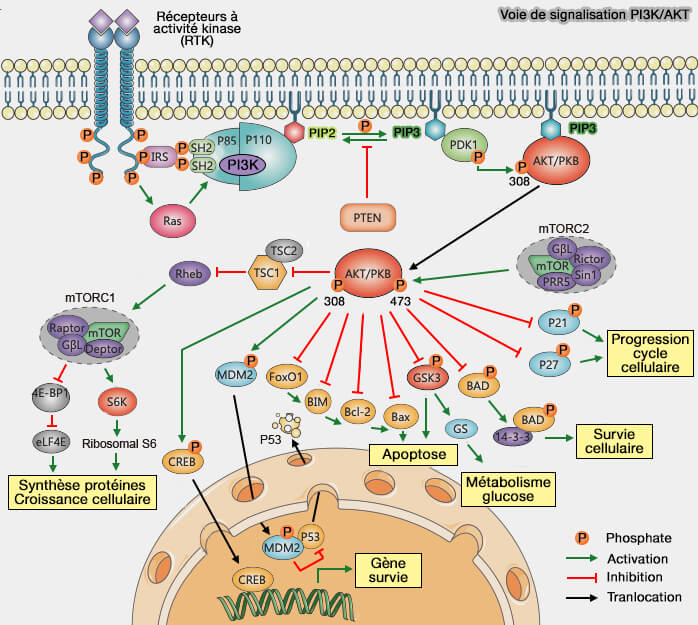
- la voie PI3K/AKT, la voie la plus étudiée en raison de son grand nombre de substrats, AKT (PKB) étant une Ser/Thr kinase qui appartient à la famille AGC, nommée d'après les kinases PKA, PKG et PKC (PI3K/AKT Signal Pathway: A Target of Natural Products in the Prevention and Treatment of Alzheimer's Disease and Parkinson's Disease 2021),
- la voie mTOR dépendant de la voie PI3K/AKT.

La voie PI3K/AKT et la voie mTOR sont traitées dans des chapitres spécifiques.
PI3KC de classe Ib
La classe Ib, représenté par le seul PIK3CG, est retrouvé en grande quantité dans les leucocytes. PI3Kγ est principalement activé en aval des récepteurs couplés aux protéines G (GPCR), et la présence des différentes sous-unités adaptatrices module fortement leurs activations.

PIK3CG est un régulateur essentiel de l'immunité et une cible médicamenteuse prometteuse pour le cancer et les maladies inflammatoires.
1. Le domaine catalytique p110γ a deux particularités.
-
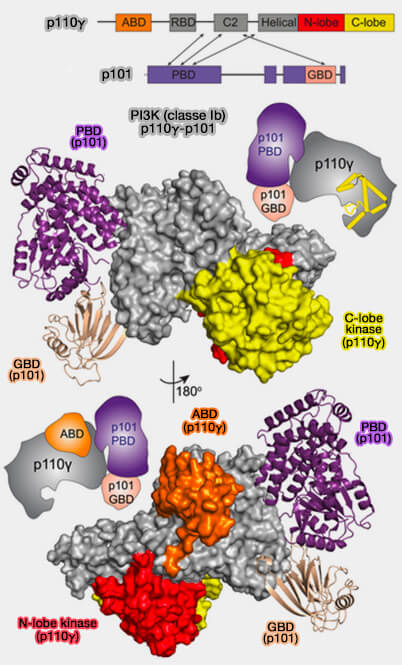
PI3K de classe II : p110γ-p101
(Figure : vetopsy.fr d'après Rathinaswamy et coll) - p110γ est caractérisé par l'absence d'ABD (Adaptator Binding Domain) par rapport aux p110 de la classe Ia. Cependant, il semblerait qu'on trouve un domaine de type ubiquitine à l'extrémité N-terminale, jouant peut-être une fonction similaire à l'ABD.
2. Les domaines régulateurs p101 et p84, i.e. différents des PI3KC de classe Ia, ne sont pas essentiels à la stabilité de p110 et n'inhibent pas l'activité de la lipide kinase mais, sont responsables de l'activation des stimuli en amont (Structure of the phosphoinositide 3-kinase (PI3K) p110γ-p101 complex reveals molecular mechanism of GPCR activation 2021).
p101 ou p84 sont dépourvus de domaine SH2 et présentent des profils d'expression distincts : ils modifient les réponses de signalisation PI3Kγ lors d'entrées en amont différentes.
- In vivo, La sous-unité catalytique p110γ seule ne peut pas être activée en aval des GPCR et nécessite les sous-unités régulatrices p101 ou p84 pour répondre aux GPCR (Gβγ is a direct regulator of endogenous p101/p110γ and p84/p110γ PI3Kγ complexes in mouse neutrophils 2020).
- In vitro, la sous-unité p101 forme un hétérodimère obligatoire avec p110γ, tandis que p84 forme une interaction transitoire plus faible avec p110γ (p87 and p101 Subunits Are Distinct Regulators Determining Class IB Phosphoinositide 3-Kinase (PI3K) Specificity 2013).
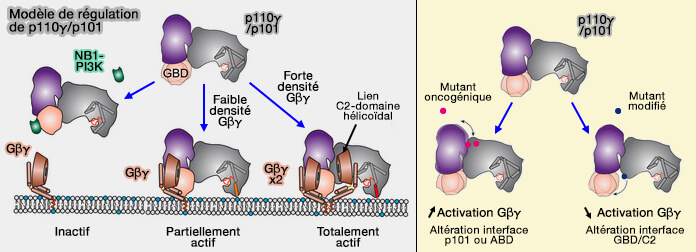
(Figure : vetopsy.fr d'après Rathinaswamy et coll)
Les réponses de signalisation différentes ont été attribuées à la sensibilité différentielle de chacun des hétérodimères PI3Kγ aux sous-unités Gβγ.
- p84 activerait la production d'espèces d'oxydes réactifs (ROS) en nécessitant une liaison Ras pour l'activation (Ras is an indispensable coregulator of the class IB phosphoinositide 3-kinase p87/p110γ 2009).
- p101 altérerait la migration des neutrophiles (The regulatory subunits of PI3Kg control distinct neutrophil response 2015) par son activation préférentielle par Gβγ (Molecular determinants of PI3Kγ-mediated activation downstream of G-protein–coupled receptors (GPCRs) 2013).
PI3K de classe II : PI3KC2
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesProtéines kinasesLipides kinasesHydrolasesPeptidases/protéasesPhosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


