Domaines protéiques
Domaine SH2 (Src Homology 2)

Le domaine SH2 (Src Homology 2) est un domaine protéique structurellement conservé dans de nombreuses protéines transductrices de signal intracellulaires, qui se lie, comme le domaine PTB, à la phosphotyrosine (pY).
Il a été découvert dans l'oncoprotéine Src, d'où son nom.
Structure du domaine SH2
Les domaines SH2 comprennent environ 100 résidus.
1. Le domaine comprend :
- deux hélices α flanquant,
- trois à cinq brins β anti-parallèles qui composent un feuillet β (β sheet) central.
Cette structure tridimensionnelle hautement conservée fait des domaines SH2 des systèmes modèles pour les études de pliage des protéines.

Vous pouvez lire : SH2 Domains: Folding, Binding and Therapeutical Approaches (2022) qui étudie en détail les domaines SH2 et qui est résumé dans ce chapitre.
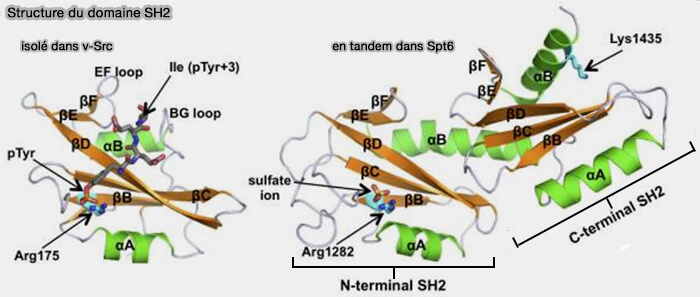
(Figure : vetopsy.fr d'après Kaneko et coll)
2. Dans les domaines SH2, deux régions structurales déterminent l'interaction protéine-ligand.
a. Un résidu arginine (R) strictement conservé, le plus souvent dans le motif FLVR, joue un rôle central dans la formation d'une double liaison hydrogène avec le groupe phosphate de pY.
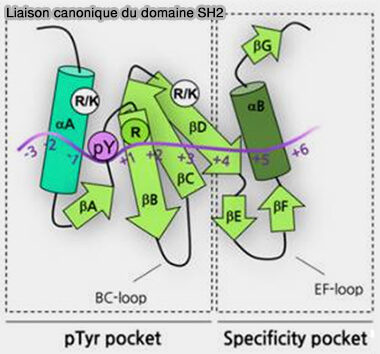
(Figure : vetopsy.fr d'après Diop et coll)
Ce motif est situé dans une rainure formée par l’hélice αA, les brins βB/βC/βD et la boucle BC.
b. Une grande poche hydrophobe spécifique, constituée par l’hélice αB, le brin βD et les boucles BG et EF, prend en charge les résidus qui sont C-terminaux par rapport à pTyr.
La région N-terminale qui fournit la poche de liaison pTyr est plus conservée que la moitié C-terminale du domaine SH2 à plus grande variabilité structurelle (Phosphotyrosine recognition domains: the typical, the atypical and the versatile 2012).
3. Les autres résidus qui sont essentiels pour la liaison des phosphopeptides sont l'histidine βD4, la lysine βD6 et l'arginine αA2, qui coordonnent et attachent le cycle aromatique de la phospho-tyrosine (The language of SH2 domain interactions defines phosphotyrosine-mediated signal transduction 2012).
- La plupart des domaines SH2 affichent des préférences de liaison pour des résidus spécifiques aux positions 2 et 4,par rapport à pTyr dans la séquence des ligands (Defining the Specificity Space of the Human Src Homology 2 Domain 2008).
- Il est possible de diviser SH2 en trois groupes différents sur la base de la séquence de consensus reconnue (
tableau).
4. Les domaines SH2 peuvent être isolés ou en tandem avec d'autres modules de liaison aux protéines.
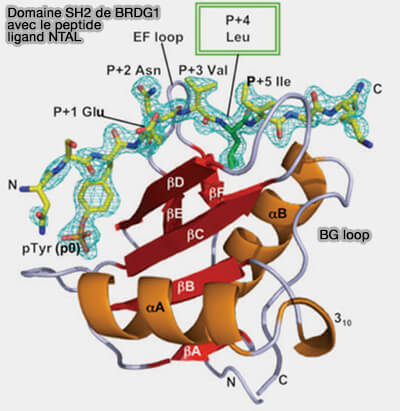
(Figure : vetopsy.fr d'après Kaneko et coll)
a. On note la présence simultanée de trois poches de liaison, qui montrent une sélectivité pour les résidus +2, +3 et +4 du phosphopeptide dans toutes les structures SH2 considérées.

Vous pouvez lire : Loops Govern SH2 Domain Specificity by Controlling Access to Binding Pockets (2019), qui détaille les mécanismes.
b. On a émis l'hypothèse que les boucles EF et BG sont des régulateurs des poches de liaison SH2, ce qui n'est pas l'apanage des domaines SH2 (
Le mécanisme par lequel les boucles régulent l'accessibilité des poches de liaison semble être unique parmi les modules d'interaction protéine-protéine.
Remarque : les domaines SH2
interviennent dans la formation de condensats (
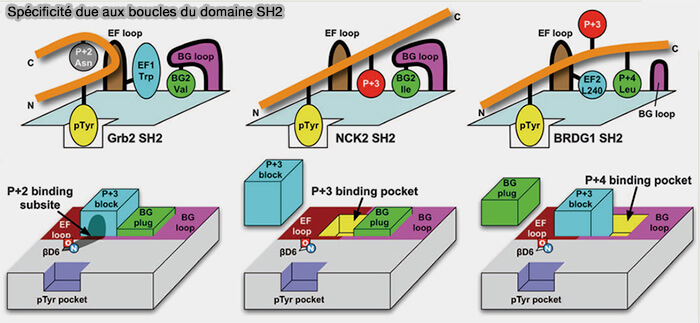
(Figure : vetopsy.fr d'après Kaneko et coll)
Rôles des domaines SH2
Le domaine SH2 est présent dans plus d'une centaine de protéines humaines (
1. Les domaines SH2 sont présents dans :
- les enzymes, comme les kinases CrK2, BtK, Src,
- les SHIP (SH2-containing Inositol Phosphatase), PPI 5-phosphatases de type III,
- les adaptateurs et régulateurs, par exemple, p85 des PI3KC de classe a,
- les protéines d'attache comme la thymosine-β4 (Tβ4), Shc…,
- les protéines du cytosquelette comme la tensine…
2. Les domaines SH2 sont particulièrement fréquents dans les protéines des adaptateurs qui contribuent à la transduction du signal des récepteurs tyrosine kinases (RTK), comme les voies RAS-MAPK, JAK/STAT et PI3K/AKT (Phosphotyrosine Signaling Proteins that Drive Oncogenesis Tend to be Highly Interconnected 2013).
La liaison d'une protéine contenant de la phosphotyrosine à un domaine SH2 peut entraîner l'activation ou l'inactivation de la protéine contenant le SH2, en fonction des types d'interactions formées entre le domaine SH2 et d'autres domaines de l'enzyme.
3. La dysrégulation de ces voies due à des mutations ou à une modification de l'expression de protéines contenant SH2 induit plusieurs troubles et maladies, comme (
- le syndrome de Noonan (NS),
- les cancers,
- les maladies auto-immunes, i.e. l'agammaglobulinémie liée au sexe et le déficit immunitaire combiné sévère.
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


