Fusion vésiculaire : protéines SNARE
Régulation des protéines SNARE
Modèles de régulation par les synaptotagmines et la complexine (1-2)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les protéines des familles synaptotagmine et complexine constituent une classe de régulateurs des protéines SNARE qui sont particulièrement importantes dans les événements de fusion déclenchés par le calcium.

(Figure : vetopsy.fr d'après Park et Ryu)
Différents modèles controversés ont été formulés pour expliquer comment la synaptotagmine-1 (Syt1) et la complexine (Cplx) couplent la liaison Ca++ à la fusion membranaire (Models of synaptotagmin-1 to trigger Ca2+-dependent vesicle fusion 2018).
Certains modèles sont probables et ne s'excluent pas forcément :
- Modèle 1 : déverrouillage des SNARE par Syt1 en déplaçant Cplx,
- Modèle 2 : courbure de la membrane par Syt1,
- Modèle 3 : oligomérisation circulaire.
D'autres modèles sont moins probables :
- Modèle 4 : verrouillage des SNARE par Syt1,
- Modèle 5 : pontage membranaire,
- Modèle 6 : régulateur de distance VS/MP.

Les questions principales sont les suivantes :
- Syt1 se lie-t-elle au complexe SNARE, à la membrane présynaptique ou aux deux, lors de l'amarrage des vésicules dans un environnement ionique physiologique qui comprend ATP/Mg++ (Synaptotagmin-1 C2B domain interacts simultaneously with SNAREs and membranes to promote membrane fusion 2016) ?
- Comment Syt1, avec la complexine (Cplx), contrôle le verrouillage du complexe SNARE pour restreindre la fusion spontanée avant l'augmentation de Ca++ ?
- Si la complexine est un facteur de verrouillage du complexe SNARE, comment la fusion des vésicules s'arrête avant l'augmentation de Ca++ ?
- Comment Syt1 débloque le verrouillage et enclenche la fermeture complète du complexe SNARE pour déclencher la fusion membranaire dépendante de Ca++ ?
Modèles probables ne s'excluant pas
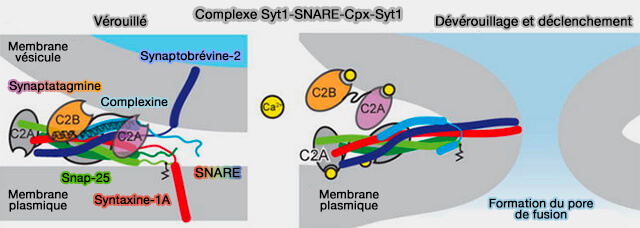
Modèle 1 : déverrouillage des SNARE par Syt1 en déplaçant Cplx

Nous avons décrit en détail ce modèle qui pourrait être cohérent avec le modèle de l'oligomérisation circulaire de Syt1 (
1. Lors de l'arrivée du Ca++, Syt1 interagit avec les membranes et avec le complexe SNARE partiellement zippé et déplace la complexine (Cplx) qui vérouille la fermeture complète des SNARE.
Remarque : l'inactivation de la complexine varie selon les espèces, de sorte que la généralisation de la fonction de la complexine est difficile.

(Figure : vetopsy.fr d'après Zhou et coll)
2. Toutefois, ce modèle ne pourrait s'appliquer qu'à des synapses spécialisées et cette hypothèse reste controversée.

Actuellement, aucune preuve directe ne montre que Syt1 déclenche une fermeture éclair SNARE complète en déplaçant ou en remplaçant la complexine qui inhiberait la fusion des vésicules.
Le vérouillage des SNARE par Cplx est toujours débattu.
- La fusion spontanée des vésicules est soit non affectée, soit réduite dans les neurones de mammifères déficients en complexine.
- Dans l'environnement ionique physiologique, Syt1 se lie principalement aux phospholipides anioniques sans interagir avec le complexe SNARE (
synaptotagmine et lipides membranaires).
- Syt1 ne parvient pas à se lier au complexe SNARE même en présence de complexine dans les conditions physiologiques (Synaptotagmin-1 binds to PIP2-containing membrane but not to SNAREs at physiological ionic strength 2015).

(Figure : vetopsy.fr d'après Perez-Lara et coll)
3. Cependant, Cplx pourrait inhiber la libération spontanée par d'autres processus tout au long de l'interaction de la membrane et du complexe t-SNARE (Membrane curvature sensing by the C-terminal domain of complexin 2014).
a. Cplx se lierait (Complexin Binding to Membranes and Acceptor t-SNAREs Explains Its Clamping Effect on Fusion 2017) :
- au complexe SNARE à quatre hélices assemblé de Stx1/SNAP-25/VAMP2, mais aussi,
- à un complexe t-SNARE binaire (1:1) de Stx1/SNAP-25 avec une affinité élevée tout en interagissant simultanément avec la bicouche lipidique. Ce complexe subit une fusion rapide avec des vésicules VAMP2 (
modèle de compétition).
Ces interactions protéiques et membranaires de Cplx sont coopératives, i.e. le complexe t-SNARE améliore l'affinité membranaire de Cplx et les SNARE associés à la membrane sont également plus susceptibles d'interagir avec Cplx que leurs homologues solubles.
b. Cplx pourrait aussi se lier par ses extrémités N- et C-terminales à la membrane, i.e. ces interactions sont dépendantes de la courbure de la membrane et indépendantes l'une de l'autre (
Cplx inhiberait la libération spontanée en inhibant l'amarrage des vésicules, et ce, en réduisant l'affinité de VAMP pour les t-SNARE.
Modèle 2 : courbure de la membrane par Syt1
Le modèle 2 suppose que Syt1 lié au Ca++ induit la courbure positive locale dans la membrane plasmique, abaissant ainsi la barrière d'énergie pour la fusion médiée par SNARE (
1. L'insertion membranaire Ca++-dépendante est la propriété la plus caractéristique des domaines C2A/B de Syt1 qui se lie aux phospholipides anioniques chargés négativement (
(Figure : vetopsy.fr d'après Zhou et coll)
2. Le domaine C2B de Syt1 provoque une courbure positive de la membrane plasmique de manière dépendante du Ca++ (
Modèle 3 : oligomérisation circulaire
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


