Transport des lipides : lipoprotéines
Apolipoprotéines
ApoA-V
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine A5 (apoA-V), de la famille des apoA, est avec l'apoC-II, les seuls activateurs de la lipoprotéine lipase (LPL).
Structure de l'apoA-V
L'apoa-V est codée par le groupe de gènes APOA1/C3/A4/A5 (Apolipoprotein A-V dependent modulation of plasma triacylglycerol: A puzzlement 2012).
L'apoA-V est principalement synthétisée par le foie, mais aussi en petite quantité par l'intestin (APOA5 gene expression in the human intestinal tissue and its response to in vitro exposure to fatty acid and fibrate 2012).
L'apoA-V est la seule apoA à ne pas être glycosylée.
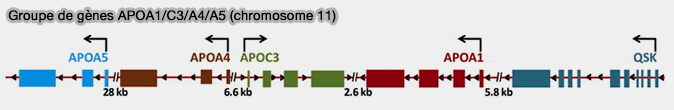
(Figure : vetopsy.fr d'après Halley et coll)
1. La protéine apoA-V comprend 366 résidus d'acides aminés, dont 23 acides aminés codent pour le peptide signal (Structure and Interfacial Properties of Human Apolipoprotein A-V 2003).
2. L'apoA-V comprend plusieurs domaines dont deux domaines repliés indépendamment.
-
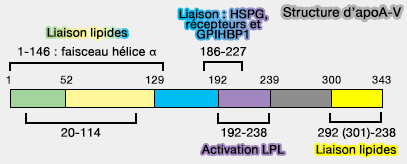
Structure de l'apoA-V
(Figure : vetopsy.fr d'après Su et coll) - Le domaine C-terminal (293–343) médie sa liaison aux lipides (Structure and Interfacial Properties of Human Apolipoprotein A-V 2003).
En outre, un domaine de liaison aux lipides (161-181) hautement hydrophobe gère l'interaction entre l'apoA-V et la surface des goutelettes lipidiques (Apolipoprotein A-V; a potent triglyceride reducer 2011).
Fonctions de l'apoA-V
Dans les TRL en général
L'apoA-V, produite par le foie, est présente à de très faibles concentrations dans le plasma, moins d'une par particule de lipoprotéine (The Novel Apolipoprotein A5 Is Present in Human Serum, Is Associated with VLDL, HDL, and Chylomicrons, and Circulates at Very Low Concentrations Compared with Other Apolipoproteins 2005).
L'apoA-V et l'apoC-III sont d'importants modulateurs opposés du métabolisme des triglycérides (TG) plasmatiques (Emerging evidences for the opposite role of apolipoprotein C3 and apolipoprotein A5 in lipid metabolism and coronary artery disease 2019).
- La déficience en apoA-V induit une augmentation (+ 400%) du taux plasmatique de TG, alors que sa surexpression entraîne une réduction (- 70%) du taux sérique de TG.
- La déficience en apoC-III provoque une diminution (-30%) du taux plasmatique des TG, alors que sa surexpression produit une augmentation (+ 200% à 2000%) de leur taux sérique.
1. L'apoA-V circulante, comme l'apoC-III, est principalement associée :
- aux lipoprotéines riches en triglycérides, TRL (Triglyceride-Rich Lipoproteins), TRL qui englobent les chylomicrons et les lipoprotéines de très basse densité (VLDL),
- aux lipoprotéines de haute densité (HDL).
Ces deux apolipoprotéines sont échangeables entre ces lipoprotéines.
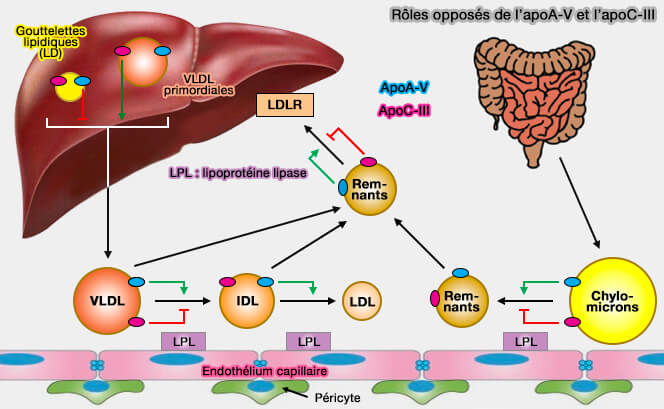
(Figure : vetopsy.fr)
2. La distribution de l'apoA-V entre ces lipoprotéines dépend de l'état métabolique des individus, i.e. est étroitement associée à la teneur en triglycérides (TG) dans les TRL.
- La majorité des apoA-V se trouvent dans les HDL lorsque les TRL possèdent des taux faibles de triglycérides (TG).
- Une grande partie de l'apoA-V est redistribuée des particules HDL aux particules TRL lorsque les quantités de TG augmente dans le TRL.
- L'apoA-V retourne progressivement aux HDL avec l'hydrolyse du TRL.
3. Des études mécanistes approfondies ont révélé que l'apoC-III et l'apoA-V régulaient les taux plasmatiques de TG par de multiples voies (Apolipoprotein A-V; a potent triglyceride reducer 2011).
L'apoA-V (Apolipoprotein A5 regulates intracellular triglyceride metabolism in adipocytes 2017) :
- accélère l'hydrolyse des TRL, en stimulant la LPL (LipoProtéine Lipase),
- augmente l'absorption des remnants des TRL par le foie (Influence of apolipoprotein A-V on the metabolic fate of triacylglycerol 2013),
- inhibe la sécrétion hépatique des TG.
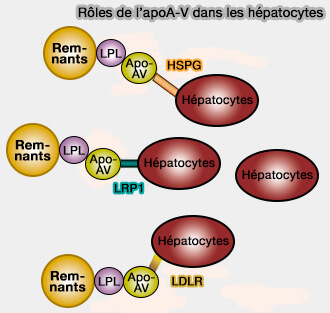
(Figure : vetopsy.fr d'après Su et coll)
4. l'apoA-V favorise la fixation des TRL à la surface des cellules endothéliales et de telles interactions améliorent la lipolyse par la LPL(Apolipoprotein AV Accelerates Plasma Hydrolysis of Triglyceriderich Lipoproteins by Interaction with Proteoglycan-bound Lipoprotein Lipase 2005).
Cette fixation pourrait se faire par le domaine (186-227) chargé positivement sur :
- les récepteurs HSPG (Give me A5 for lipoprotein hydrolysis! 2005 et Apolipoproteins E and AV mediate lipoprotein clearance by hepatic proteoglycans 2013),
- GPIHBP1 (Clinical and genetic features of 3 patients with familial chylomicronemia due to mutations in GPIHBP1 gene 2016 et Intravenous Injection of Apolipoprotein A-V Reconstituted High-Density Lipoprotein Decreases Hypertriglyceridemia in apoav−/− Mice and Requires Glycosylphosphatidylinositol-Anchored High-Density Lipoprotein–Binding Protein 2010),
- les récepteurs LDLR qui sont essentiels dans la captage des remnants dans le foie (Apolipoprotein A-V Interaction with Members of the Low Density Lipoprotein Receptor Gene Family 2007).

L'apoC-III fait exactement le contraire (
Dans les VLDL et les gouttellettes lipidiques
1. L'apoA-V inhibe la sécrétion de VLDL (lipoprotéines de très basse densité) et favorise le stockage des triglycérides (TG) dans les goutelettes lipidiques (LD ou Lipid Droplet) cytosoliques (Biogenesis of apolipoprotein A-V and its impact on VLDL triglyceride secretion 2011 et New insights into apolipoprotein A5 in controlling lipoprotein metabolism in obesity and the metabolic syndrome patients 2018 et Effects and mechanisms of apolipoprotein A-V on the regulation of lipid accumulation in cardiomyocytes 2018).
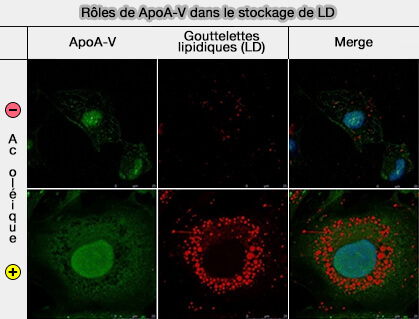
(Figure : vetopsy.fr d'après Luo et coll)
Quelques apoA-V sont également sécrétées avec les VLDL, i.e. le rapport estimé est de 1 molécule de apoA-V pour 24 particules de VLDL (Update on APOA5 Genetics: Toward a Better Understanding of Its Physiological Impact 2017).

Par contre, on ne connait pas le mécanisme exact.
2. Cependant, si l'apoA-V se lie à LRP1, récepteur de la famille LDLR, sa liaison avec VLDLR n'a pas été démontrée (Apolipoprotein AV interaction with members of the low density lipoprotein receptor gene 2007).
- LRP1 joue un rôle dans l'absorption de l'apoA-V qui est internalisé par les adipocytes humains et diminue significativement la teneur en triglycérides intracellulaires (Endocytosis of Apolipoprotein A-V by Members of the Low Density Lipoprotein Receptor and the Vps10p Domain Receptor Families 2008).
- L'absorption d'apoA-V est diminuée dans les tissus adipeux des humains obèses et dans les adipocytes en culture présentant une hypertrophie ou une résistance à l'insuline (Apolipoprotein A5 regulates intracellular triglyceride metabolism in adipocytes 2017).
L'apoA-V pénètre dans les adipocytes, où il se co-localise avec la périlipine autour des goutelettes lipidiques (LD ou Lipid Droplet) pour empêcher le stockage des TG.
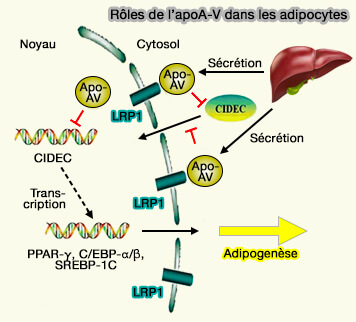
(Figure : vetopsy.fr d'après Su et coll)
2. L'emplacement subcellulaire de l'apoA-V et de l'apoC-III régulant la lipidation des VLDL pourrait être le réticulum endoplasmique (RE).
- L'apoA-V pourrait faciliter le bourgeonnement des gouttelettes lipidiques luminales (lLD) pour former des LD cytosoliques (cLD), et donc réduire les triglycérides (TG) des VLDL (Influence of apolipoprotein A-V on hepatocyte lipid droplet formation 2012).
- L'apoC-III favorisait la fusion des lLD avec des VLDL pendant leur lipidation (Missense Mutation in APOC3 within the C-terminal Lipid Binding Domain of Human ApoC-III Results in Impaired Assembly and Secretion of Triacylglycerol-rich Very Low Density Lipoproteins 2011).
Remarque : l'apoA-V peut également prévenir la production de chylomicrons intestinaux.
Bien que sa synthèse intestinale est très faible, l'apoA-V peut également atteindre l'intestin depuis le foie via les sels biliaires (Apolipoprotein A-V is present in bile and its secretion increases with lipid absorption in Sprague-Dawley rats 2015).

Étant donné que l'apoC-III et de l'apoA-V régulent le métabolisme des lipides et s'associent au risque de coronaropathie de manière opposée, il est concevable de se demander s'ils ne se régulent pas au niveau transcriptionnel.
Dans les HDL
Les HDL (lipoprotéines de haute densité) exerce diverses propriétés athéroprotectrices, notamment la médiation de l'efflux de cholestérol, la protection de l'endothélium vasculaire, des effets anti-inflammatoires et anti-apoptotiques (Translation of High-Density Lipoprotein Function Into Clinical Practice 2013).

Les rôles de l'apoC-III son étudiés dans les maladies liées à ses dysfonctionnements.
Comme l'apoA-V a une action contraire à celle de l'apoC-III, sa surexpression a provoqué une augmentation de l'apoA-V dans les HDL, associée à une augmentation de la capacité d'efflux du cholestérol (Effects of apoA-V on HDL and VLDL metabolism in APOC3 transgenic mice 2007).
Les HDL reconstituées synthétisées avec plus d'apoA-V ont une taille plus grande, une teneur plus élevée en lipides et une meilleure capacité antioxydante que les HDL in vitro.
Retour aux apolipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


