Transport des lipides : lipoprotéines
Apolipoprotéines : apoC
ApoC-III : généralités
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apoC-III, apolipoprotéine C la plus abondante chez l'homme, est principalement produite dans le foie, et dans une moindre mesure dans l'intestin.
Vue d'ensemble de l'apoC-III
L'apoC-III est codée par le groupe de gènes APOA1/C3/A4/A5.
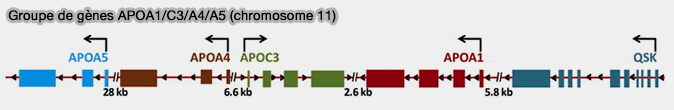
(Figure : vetopsy.fr d'après Halley et coll)
1. Dans la circulation, l'apoC-III est principalement présente sur :
- les lipoprotéines riches en triglycérides (TRL), i.e. chylomicrons et lipoprotéines de très basse densité (VLDL),
- les lipoprotéines de haute densité (HDL),
Dans une moindre mesure, elle se trouve sur les LDL (lipoprotéines de basse densité).
2. La répartition de l'apoC-III entre ces lipoprotéines dépend de l'état métabolique des individus, i.e. est étroitement associée à la teneur en triglycérides (TG) dans les TRL.
- La majorité des apoC-III se trouvent dans les HDL lorsqu'il y avait de faibles taux de TG dans les TRL.
- Une grande partie de l'apoC-III est redistribuée des particules HDL aux particules TRL lorsque les quantités de TG ont augmenté dans le TRL.
- L'apoC-III retourne progressivement aux HDL avec l'hydrolyse du TRL.

L'apoC-III et l'apoA-V sont d'importants modulateurs opposés du métabolisme des triglycérides plasmatiques.
Structure de l'apoC-III
1. L'apoC-III est une petite protéine (79 résidus) qui contient deux hélices amphipathiques (Structure and Dynamics of Human Apolipoprotein CIII 2008).
Pour l'instant, la compréhension détaillée de sa structure et de sa fonction n'est pas claire et on ne sait pas exactement quelles régions interagissent avec les particules de lipoprotéines, les enzymes et les récepteurs cellulaires.
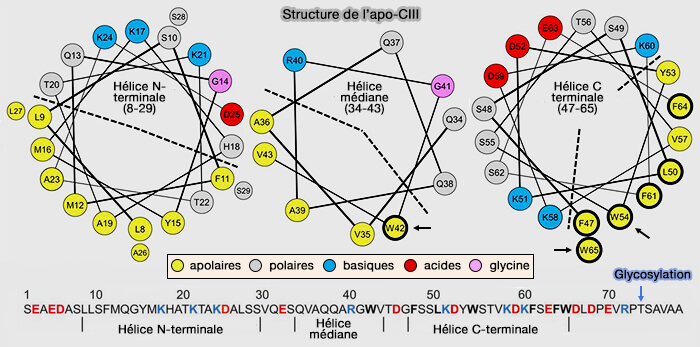
(Figure : vetopsy.fr d'après Meyers et coll)
Les deux hélices amphipathiques et les résidus de tryptophane dans la moitié C-terminale de l'apoC-III semblent être importants pour sa capacité à interagir avec les TRL (Aromatic residues in the C terminus of apolipoprotein C-III mediate lipid binding and LPL inhibition 2017).
2. Une fois synthétisée, l'apoC-III peut subir une modification post-traductionnelle sur la thréonine 74, et trois glycoformes différentes ont été décrites avec zéro, un ou deux acides sialiques, appelés apoC-III0 non sialylée, apoC-III1 monosialylée et apoC-III2 disialylée (Development of multiplex mass spectrometric immunoassay for detection and quantification of apolipoproteins C-I, C-II, C-III and their proteoforms 2015).
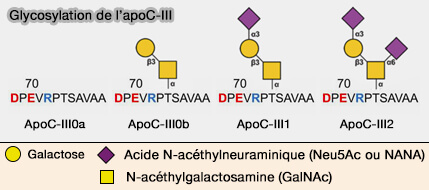
(Figure : vetopsy.fr d'après Ramms et coll)
a. Cette modification post-traductionnelle modifie l'élimination des différents glycoformes par les récepteurs hépatiques (apoC-III Glycoforms Are Differentially Cleared by Hepatic TRL (Triglyceride-Rich Lipoprotein) Receptors 2019).
b. Le degré de sialylation, i.e. ajout d'acide sialique, influence la fonction de l'apoC-III.
- L'apoC-III1 est plus fortement corrélée à des taux plasmatiques élevés de triglycérides (TG) que l'apoC-III2 (The Association of Human Apolipoprotein C-III Sialylation Proteoforms with Plasma Triglycerides 2015).
- Un rapport apoC-III2/apoC-III1 plus élevé associé à des taux de triglycérides plus faibles (Disialylated apolipoprotein C-III proteoform is associated with improved lipids in prediabetes and type 2 diabetes 2016).
c. L'apoC-III2 inhibe moins efficacement l'hydrolyse médiée par la LPL (LipoProtéine Lipase) des TRL que l'apoC-III1, malgré une affinité apparente deux fois plus grande pour le TRL que les deux autres a isoformes (Inhibitory Effects of Specific Apolipoprotein C-III Isoforms on the Binding of Triglyceride-rich Lipoproteins to the Lipolysis-stimulated Receptor 1997).
Fonctions générales de l'apoC-III
L'apoC-III et l'apoA-V sont d'importants modulateurs opposés du métabolisme des triglycérides (TG) plasmatiques (Emerging evidences for the opposite role of apolipoprotein C3 and apolipoprotein A5 in lipid metabolism and coronary artery disease 2019).
- La déficience en apoC-III provoque une diminution (-30%) du taux plasmatique des TG, alors que sa surexpression produit une augmentation (+ 200% à 2000%) de leur taux sérique.
- La déficience en apoA-V induit une augmentation (+ 400%) du taux plasmatique de TG, alors que sa surexpression entraîne une réduction (- 70%) du taux sérique de TG.
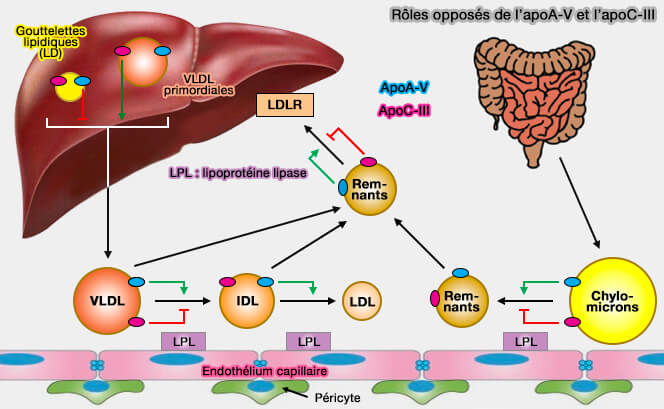
(Figure : vetopsy.fr)
1. Initialement, on pensait que l'apoC-III augmentait les taux de triglycérides en inhibant la lipolyse dépendante de la LPL (LipoProtéine Lipase).
Cependant, l'apoC-III le fait de manière indirecte par plusieurs mécanismes (Apolipoprotein C-III in triglyceride-rich lipoprotein metabolism 2018).
- Elle déplace les lipoprotéines de la surface cellulaire chargée négativement (Chylomicronemia due to Apolipoprotein CIII Overexpression in Apolipoprotein E-null Mice 1997).
- Elle déplace l'apoC-II, l'activateur de la LPL, de la lipoprotéine (Apolipoproteins C-I and C-III Inhibit Lipoprotein Lipase Activity by Displacement of the Enzyme from Lipid Droplets 2013).
Surtout, l'apoC-III induirait des changements conformationnels de l'apoE.
2. Des études in vivo avec des souris transgéniques apoC-III ont démontré que la surexpression d'apoC-III induit une hypertriglycéridémie marquée en raison de l'accumulation de remnants avec une diminution de la teneur en apoE par rapport aux témoins (Hypertriglyceridemia as a Result of Human apo CII Gene Expression in Transgenic Mice 1990).

Récemment, il est devenu évident que l'apoC-III inhibe la clairance des remnants de TRL, via leurs récepteurs, i.e. LDLR, LRP1 et SDC1, et non en inhibant la LPL (LipoProtéine Lipase).
Fonctions de l'apoC-III dans les différentes lipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


