Lipides
Trafic non vésiculaire
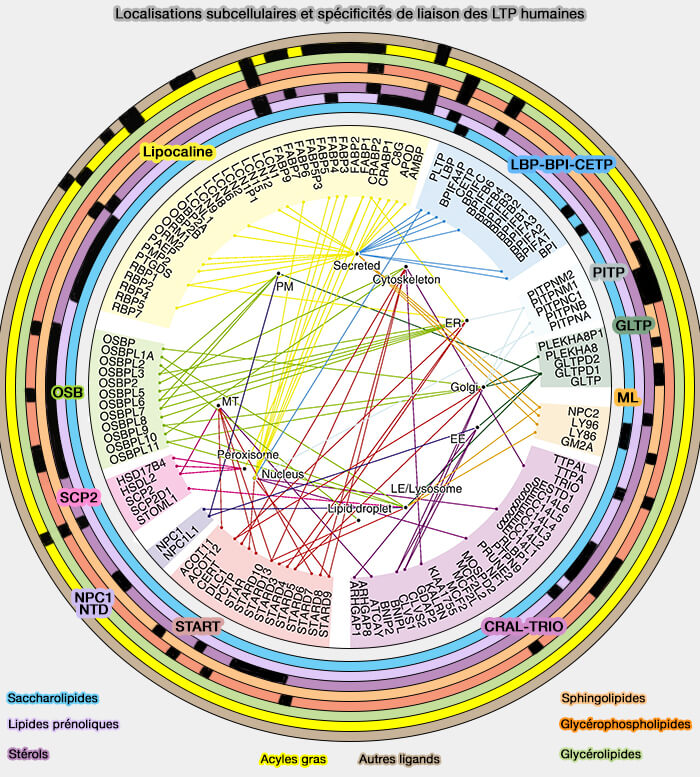
LTP ou protéines de transfert des lipides
Famille GRAMD/Lam
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les protéines GRAMD/Lam, famille conservée par l'évolution, protéines de transfert des lipides (LTP ou Lipid Tranfer Protein) sont impliquées dans leur trafic non vésiculaire par navette, en particulier au niveau des sites de contact membranaires de la membrane plasmique.
(Figure : vetopsy.fr d'après Chiapparino et coll)
1. Les LTP intracellulaires se localisent sur les sites de contact membranaire (MCS) au sein desquelles les LTP peuvent transférer les lipides d'un compartiment donneur à un compartiment accepteur (Lipid transfer proteins: the lipid commute by shuttles, bridges and tubes 2019).
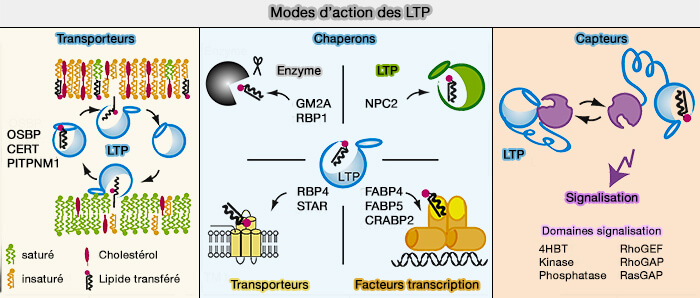
2. Les LTP peuvent remplir au moins l'une des trois fonctions principales dans les cellules en agissant comme (
- transporteurs pour transférer des lipides entre les membranes,
- chaperons pour présenter des lipides à une protéine acceptrice, i.e. enzymes, autres LTP, transporteurs transmembranaires ou facteurs de transcription,
- capteurs (détecteurs) pour modifier une interaction avec d'autres protéines en réponse à la liaison ou à la libération d'un lipide.
(Figure : vetopsy.fr d'après Chiapparino et coll)
La famille GRAMD/Lam/LC, famille conservée par l'évolution, comprend plusieurs membres qui contrôle le transfert de stérols entre la membrane plasmique et d'autres organites au niveau des sites de contact membranaire (MCS).
LAM signifie : LTP Anchored at Membrane contact sites.
Remarque importante : selon les auteurs, la famille des protéines GRAMD des métazoaires peut aussi appelée protéines ASTER.
Domaine START-like et ASTER
La famille GRAMD/Lam/LC possède un domaine proche du domaine START, appelé START-like ou STARTkin, i.e. version tronquée du pli canonique α/β helix-grip (Molecular basis for sterol transport by StART-like lipid transfer domains 2018)..
1. Dans les protéines Lam/LC de la levure, le domaine START-like est composé de :
- un feuillet β à six brins (β1-β6),
- un faisceau à trois hélices (α1-α3).
a. Par rapport au domaine START canonique, il manque l'hélice α et les deux brins β adjacents présents à l'extrémité N-terminale.
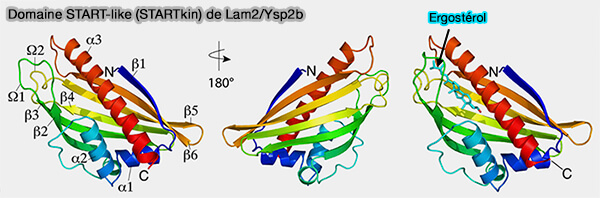
(Figure : vetopsy.fr d'après Horenkamp et coll)
b. L'un des brins au bord de β4 est remplacé par un segment coiled-coil aléatoire dans Lam2/Ysp2p, où deux résidus de proline (P893 et P895) interfèrent avec les interactions de liaison hydrogène avec le brin β adjacent, i.e. β5 dans les domaines StART.
c. La boucle Ω2 reliant β4 à β5 dans Lam2 fait partie de la paroi de la cavité, alors que dans les STARD, reliant β7 à β8, elle se tasse contre le feuillet β à l'extérieur de la cavité.
(Figure : vetopsy.fr d'après Sandhu et coll)
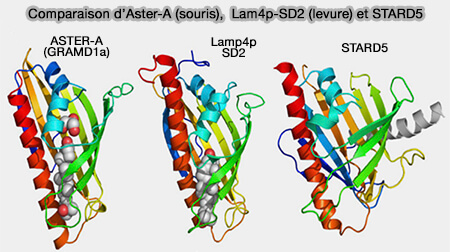
2. Dans les protéines GRAMD des métazoaires, le domaine START-like, appelé par certains domaine ASTER, malgré l'identité de séquence relativement faible, possède une structure tridimensionnelle fortement similaire (Aster Proteins Facilitate Nonvesicular Plasma Membrane to ER Cholesterol Transport in Mammalian Cells 2018).
Les différences de séquence dans la poche de liaison au cholestérol entraînent un mode de liaison différent pour le ligand, de sorte que dans GRAMD1a (ASTER-A), le stérol est tourné d'environ 120° autour de l'axe long du ligand par rapport aux ligands dans les domaines START, i.e. ce qui n'est pas le cas pour les Lam.
Classification des GRAMD/Lam
1. Les protéines Lam/Ysp/Ltc de la levure comprennent 6 membres, 1-6, et contiennent un ou deux domaines START-like (A new family of StART domain proteins at membrane contact sites has a role in ER-PM sterol transport 2015).
Par exemple, les Lam peuvent transférer directement les stérols :
- Lam4 du RE à la membrane plasmique ,
- Lam6/Ltc1, par leurs interactions avec TOM70/71 de la membrane mitochondriale externe (OMM)au RE (Ltc1 is an ER-localized sterol transporter and a component of ER–mitochondria and ER–vacuole contacts 2015 et Lam6 Regulates the Extent of Contacts between Organelles 2015),
- Lam2 et Lam4 entre les liposomes (Structural basis of sterol recognition and nonvesicular transport by lipid transfer proteins anchored at membrane contact sites 2018),
(Figure : vetopsy.fr d'après Gatta et coll)
2. On compte cinq membres chez les métazoaires (GRAM domain proteins specialize functionally distinct ER-PM contact sites in human cells 2018)
- Trois GRAMD1, GRAMD1a, GRAMD1b et GRAMD1c, appelées aussi ASTER, contiennent un domaines StART-like.
- GRAMD2 et GRAMD3 en sont dépourvus.
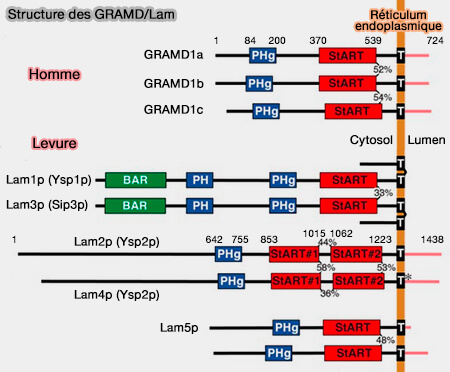
Structure des
GRAMD/Lam
1. Les GRAMD/Lam ont une structure commune et possèdent en particulier un domaine PH-like N-terminal, appelé domaine GRAM chez les GRAMD (Molecular basis of accessible plasma membrane cholesterol recognition by the GRAM domain of GRAMD1b 2021).
a. Le domaine GRAM, d'environ 70 résidus, présente une similitude structurelle avec le domaine PH :
- un feuillet β (β-sheet) N-terminal à quatre brins (β-strand),
- un feuillet β antiparallèle à trois brins qui comporte une hélice α C-terminale amphipathique.
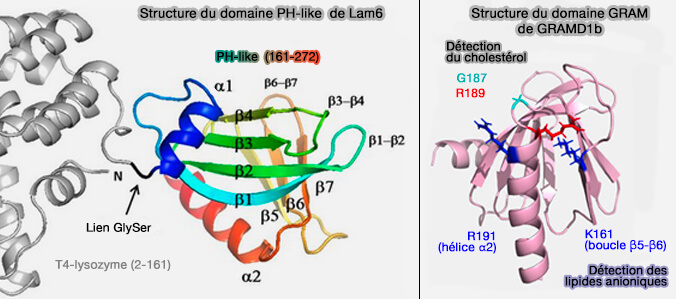
(Figure : vetopsy.fr d'après TTong et coll et Ercan et coll)
b. Ce domaine peut donc détecter ou se lier à des lipides (Structural basis of sterol recognition and nonvesicular transport by lipid transfer proteins anchored at membrane contact sites 2018).
- Le domaine GRAM de GRAMD1b possède des sites de reconnaissance distincts pour le cholestérol et les lipides anioniques afin de détecter leur codistribution dans la membrane plasmique.
- La mutation du domaine GRAM R189W, associée à une déficience intellectuelle chez l'homme, altère spécifiquement sa capacité à reconnaître le cholestérol. Un seul résidu de glycine (G187) est essentiel pour déterminer la sensibilité du domaine GRAM pour le cholestérol.
- Une mutation du domaine GRAM nouvellement identifiée (G187L) le rend hypersensible au cholestérol et peut servir d'outil pour suivre le cholestérol accessible dans le PM.
2. Le domaine C-terminal transmembranaire des GRAMD/Lam ancre les protéines au réticulum endoplasmique (RE).
Rôles des GRAMD/lam

GRAMD1a, GRAMD1b et GRAMD2, se localisent sur les MCS RE/membrane plasmique (MP).
1.. GRAMD1 détecte une augmentation transitoire du pool accessible de cholestérol de la MP et facilite son transport vers le RE au niveau des sites de contact RE-MP, contribuant ainsi à l'homéostasie du cholestérol de la MP (Movement of accessible plasma membrane cholesterol by the GRAMD1 lipid transfer protein complex 2019).
a. GRAMD1A est impliquée dans la biogenèse des autophagosomes en (The cholesterol transfer protein GRAMD1A regulates autophagosome biogenesis 2019) :
- s'accumulant sur les sites d'initiation des autophagosomes,
- en affectant la distribution du cholestérol en réponse à la dénutrition.

(Figure : vetopsy.fr d'après Wu et coll)
b. GRAMD1b facilite le transport du cholestérol dérivé des HDL (lipoprotéines de haute densité) vers le RE (Aster Proteins Facilitate Nonvesicular Plasma Membrane to ER Cholesterol Transport in Mammalian Cells 2018).
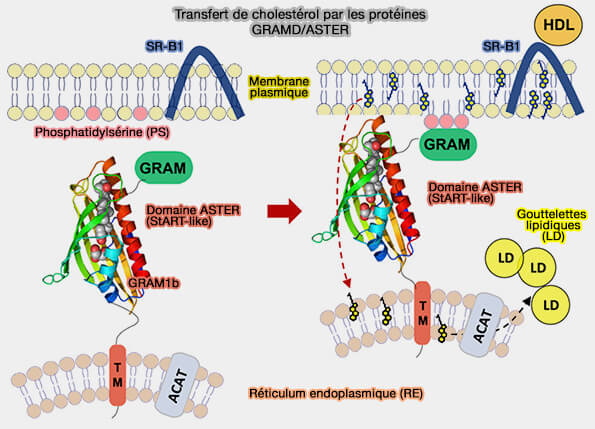
(Figure : vetopsy.fr d'après Sandhu et coll)
2. GRAMD2 facilite le recrutement de STIM1 aux contacts RE-MP et régule potentiellement l'homéostasie du Ca++ (
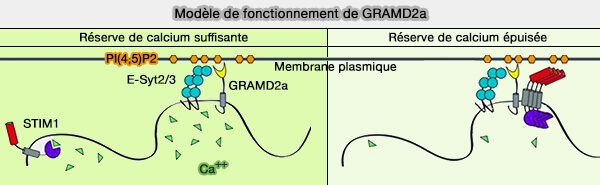
(Figure : vetopsy.fr d'après Besprozvannaya et coll)
Retour aux LTP
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesGlycérophospholipidesSphingophospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


