Cofacteurs
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Un cofacteur est un terme général qui désigne toute molécule, i.e. ion ou molécule organique non protéique, associée à une enzyme pour faciliter la catalyse, qui peut lui être liée de manière transitoire ou permanente.
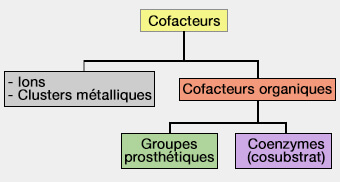
On peut classer les cofacteurs en :
- cofacteurs organiques,
- ions et clusters métalliques.
Remarque : les hydrolases se distinguent de la plupart des enzymes car elles agissent en l'absence de tout facteur non protéique.
Cofacteurs organiques
Les cofacteurs organiques sont divisés en deux groupes principaux, selon la nature de leur association avec l'enzyme.
(Figure : vetopsy.fr)
Malheureusement, les cofacteurs organiques sont quelquefois appelés coenzymes au sens large.
Coenzyme/cosubstrat
Les coenzymes sont des molécules organiques non protéiques qui se lient de manière temporaire à l'enzyme et aident à transférer des groupes chimiques pendant la réaction catalysée.
1. Les coenzymes sont souvent dérivées de vitamines ou de leurs précurseurs.
- Elles se détachent après la réaction pour être réutilisées.
- Elles assistent les enzymes à catalyser des réactions biochimiques, généralement en transférant des groupes chimiques comme des électrons, des protons (H+) ou des groupes fonctionnels comme des méthyles ($\ce{-CH3}$) ou des acyles ($\ce{R-C(=O)-}$). , quiun
2. On peut citer :
- NAD (nicotinamide adénine dinucléotide),
- FAD (flavine adénine dinucléotide),
- la coenzyme A (CoA)
- la biotine (vitamine b7)…
Remarque : le terme cosubstrat est souvent considéré comme synonyme de coenzyme au sens strict.
L'ATP, qui n'est pas une coenzyme au sens classique, peut, dans certains cas, être qualifié de coenzyme quand il se lie temporairement à l'enzyme pour transférer un groupe phosphate, puis se détache sous forme d'ADP (adénosine diphosphate) ou AMP (adénosine monophosphate), après avoir libéré de l'énergie.
Groupes prosthétiques
Les groupes prosthétiques sont un type particulier de cofacteur qui est fortement lié et de manière stable à l'enzyme, souvent de manière covalente.
Il est généralement indispensable pour l'activité de l'enzyme et reste attaché à celle-ci de manière permanente, i.e. ne se détache pas après la réaction.
Les groupes prosthétiques sont souvent des molécules organiques complexes ou des dérivés de vitamines, comme :
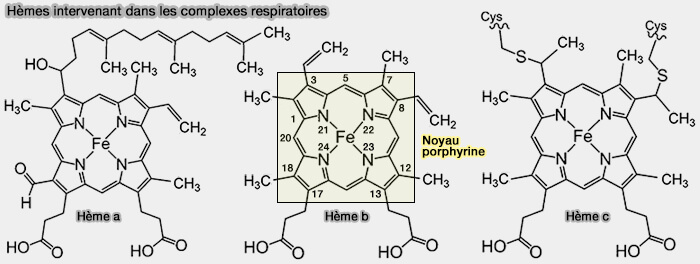
- les hèmes,
- FAD (flavine adénine dinucléotide), comme dans la succinate déshydrogénase du cycle de Krebs à laquelle elle est solidement attachée.
Remarque : FAD peut être considérée comme une coenzyme et quelquefois comme un groupe prosthétique.

Tous les groupes prosthétiques sont des cofacteurs, mais tous les cofacteurs ne sont pas des groupes prosthétiques.
(Figure : vetopsy.fr)
Cofacteurs métalliques
Les cofacteurs métalliques peuvent être
- des ions,
- des clusters métalliques.
Ions
Ces cations métalliques uniques ne sont pas associés à un groupement complexe de plusieurs atomes métalliques, i.e. clusters métalliques.
On peut citer :
1. le zinc, i.e. Zn++, un des ions métalliques les plus fréquents utilisés comme cofacteurs, est impliqué dans de nombreuses enzymes comme dans :
- l'anhydrase carbonique (EC 4.2.1.1), qui aide à maintenir l’homéostasie acido-basique, à réguler le pH et l’équilibre hydrique chez les bactéries, les plantes et les animaux,
$\ce{H2O + CO2}$ $\leftrightharpoons$ $\ce{HCO3- + H+}$
- les ADN polymérases (EC 2.7.7.7) qui utilisent des ions zinc pour maintenir leur structure et catalyser l'ajout de nucléotides lors de la réplication de l'ADN,
$\ce{DNA_n + 2'-deoxyribonucleoside 5'-triphosphate}$ $\longrightarrow$ $\ce{DNA(n+1) + diphosphate}$
- d'autres métalloprotéines…
2. le cuivre, i.e. Cu++ comme dans :
- le complexe IV de la chaîne respiratoire, i.e. CuA et CuB,
- la tyrosinase impliquée dans la production de mélanine à partir de la tyrosine…
3. le manganèse, i.e. Mn++, comme dans les phosphatases et les hydrolases…
4. le magnésium, i.e. Mg++, comme dans les ATPases, l'ARN polymérase et les kinases…
5. le calcium, i.e.Ca++, comme dans la calmoduline et certaines protéases…
6. le nickel, i.e.Ni++, comme dans certaines hydrogénases ou l'uréase (3.5.1.5).
Certains auteurs limitent le terme de cofacteur aux ions inorganiques.
Clusters métalliques
Les clusters métalliques sont définis comme des substances contenant un noyau métallique dont les atomes sont liés entre eux par des liaisons métalliques, souvent accompagnés d'autres éléments comme des atomes de soufre, de carbone, ou d'azote, pour former une structure stable.
(Figure : vetopsy.fr d'après Zéphyris)
Ils participent le plus souvent aux réactions d'oxydoréduction et de transfert d'électrons, en contribuant à la stabilité de la protéine et/ou en intervenant dans l'activation de molécules d'eau.
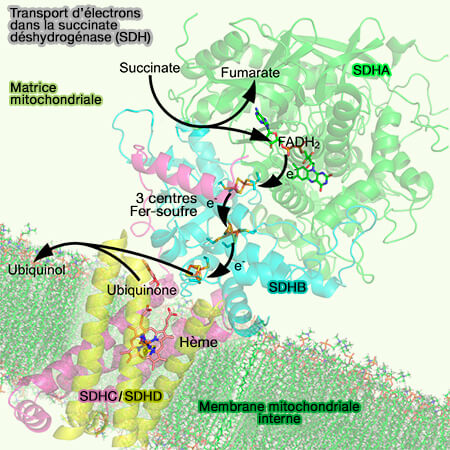
1. Les clusters fer-soufre [Fe-S], très courants dans les oxydoréductases, jouent un rôle clé dans le transfert d'électrons.
- Les clusters [Fe-S], à plusieurs configurations, i.e. [2Fe-2S], [4Fe-4S], [3Fe-4S]…, sont impliqués dans la chaîne de transport des électrons.
- Les ferrédoxines qui contiennent des clusters [2Fe-2S], participent à des réactions redox dans des processus comme la photosynthèse et le cycle de l'azote.
Ce tableau explique les différences entre les ferrédoxines et les protéines de type Rieske (ISP ou Iron Sulfur Protein).
| Caractéristiques | Ferrédoxines | Protéines de type Rieske (ISP ou Iron Sulfur Protein) |
|---|---|---|
| Cluster [Fe-S] | [2Fe-2S] ou [4Fe-4S] | [2Fe-2S] |
| Coordination Fe | 4 cystéines | 2 cystéines et 2 histidines |
| Structure du site actif | Classique, ancré uniquement par des thiols (–SH) |
Structure plus complexe avec des groupes imidazole |
| Potentiel redox | Très variable (souvent plus négatif, -0,4 à -0,1 V) |
Relativement élevé (environ +0,2 à +0,3 V) |
| Fonction principale | Transfert d’électrons | Transfert d’électrons (complexe III de la chaîne respiratoire) |
| Présence dans les organismes |
|
|
| Mobilité du centre Fe-S | Fixe dans la protéine | Domaine flexible dans la protéine |
| Exemple d’enzyme associée |
|
Remarque : d'autres clusters [Fe-S] peuvent posséder un nombre différent d'atomes (
2. Les clusters cuivre-soufre [Cu-S] peuvent intervenir dans certaines enzymes, comme la cytochrome c oxydase ou complexe IV, qui est impliquée dans la chaîne respiratoire.
3. D'autres clusters autres métaux sont formés par des atomes de zinc (Zn), manganèse (Mn), nickel (Ni), molybdène (Mo)…
- Ce sont le plus souvent des enzymes spécialisées comme des enzymes de dégradation des molécules organiques comme les alcools déshydrogénases ou certaines acyl-CoA déshydrogénases ou les enzymes impliquées dans la photosynthèse, comme le Mn dans l'oxydation de l'eau par le complexe oxygène-évolutif (OEC).
- L'un des exemples les plus connus de cluster métallique de la nitrogénase, (EC 1.8.6.1 ou 1.19.6.1), enzyme bactérienne qui fixe l'azote atmosphérique.
Cette enzyme contient, entre autres, un cluster fer-molybdène [3Fe-Mo-3S] qui catalyse la conversion de l'azote moléculaire (N2) en ammoniac (NH3), un processus clé pour l'agriculture et la fixation biologique de l'azote.
Coenzymes
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


