Glucose et bioénergétique
Photosynthèse : les deux étapes
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La photosynthèse est un processus utilisé par les plantes et d'autres organismes pour convertir l'énergie lumineuse (photons) en énergie chimique (des glucides notamment) qui, par la respiration cellulaire, peut ensuite être libérée pour alimenter les activités de l'organisme.
La photosynthèse se déroule en deux étapes :
- une étape dépendante de la lumière ou phase claire,
- une étape indépendante de la lumière ou phase sombre, i.e. cycle de Calvin.
Lors de la photosynthèse oxygénique, i.e. $\ce{H2O}$ est le donneur d'électrons (The complex architecture of oxygenic photosynthesis 2003) :
$\ce{2nCO2 + 4nH20 + photons}$ $\longrightarrow$ $\ce{2(CH2O)_n + 2nO2 + 2nH2O}$

(Figure : vetopsy.fr d'après Chiswick Chap et Des_Callaghan)
Étape dépendante de la lumière ou phase claire
La première étape de la photosynthèse, appelée aussi phase claire, est dépendante de la lumière et dépend de trois complexes dont deux utilisent des photons.
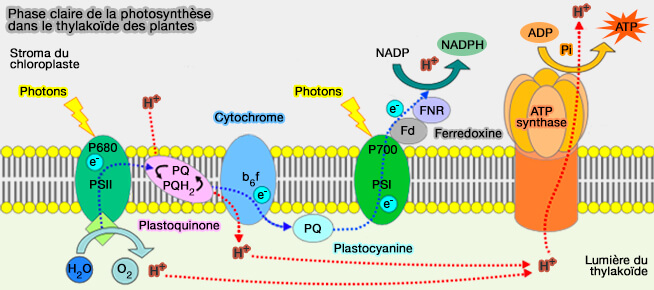
(Figure : vetopsy.fr d'après Somepics)
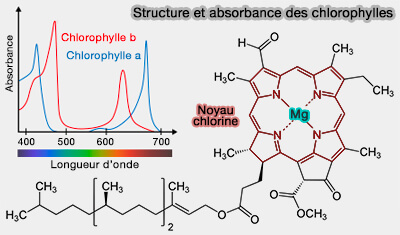
Chlorophylles
Les chlorophylles contiennent un cycle tétrapyrrolique très proche de celui de l’hème, appelé chlorine (ou porphyrine hydrogénée), avec un ion Mg++ au centre au lieu du Fe++.
- Mg++ est utilisé pour absorber la lumière et déclencher le transfert d’électrons dans les photosystèmes.
- Fe++ permet le transport d’électrons et la réaction redox.

Vous pouvez lire : From photosynthesis to biosensing: Chlorophyll proves to be a versatile molecule (2020), article qui comprend une bibliographie complète.
1. Leur biosynthèse est la même que celle de l'hème b jusqu'à la protoporphyrine IX.
a. L'ajout de magnésium nécessite la magnésium chélatase (EC 6.6.1.1), qui, contrairement à la ferrochélatase, nécessite de l'ATP.
$\ce{Protoporphyrine IX + Mg++ + ATP}$ $\longrightarrow$ $\ce{Mg-protoporphyrine IX + ADP + Pi} $
L’ATP est nécessaire pour forcer la chélation, car Mg++ est plus petit que Fe++ et s'insère moins facilement dans le noyau porphyrinique, et pour changer la conformation de la porphyrine.
b La suite de la biosynthèse nécessite l'estérification du propionate en C13 et sa cyclisation en un cycle E absent de la structure de l'hème, pour passer du cycle porphyrine au cycle chlorine (
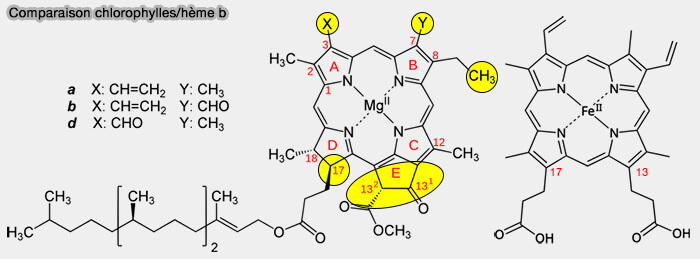
(Figure : vetopsy.fr)
2. Les chlorophylles comprennent un 5ème cycle, i.e. cycle E qui est un cycle cyclopentanone, cycle à 5 atomes, dont un atome de carbone porte une fonction cétone ou lactone essentielle à leur fonctionnement.

Dans les articles, la numérotation des carbones est souvent différente, ce qui complique les analogies.
Le cycle E, absent de l'hème, est fusionné au macrocycle au niveau du cycle D.
- La fonction cétone ($\ce{-C=O}$) modifie la distribution électronique dans le macrocycle et décale les bandes d’absorption vers le bleu et le rouge, optimisant la capture de la lumière solaire dans la photosynthèse.
- Le cycle E rigidifie le macrocycle et la chlorophylle, ce qui est essentiel dans un environnement cellulaire dynamique.
- La présence du cycle E modifie la surface moléculaire et les groupes fonctionnels accessibles et favorise les liaisons avec PSI et PSII, favorisant une organisation optimale pour le transfert d’électrons.
3. Un comparatif entre les structures de l'hème b et de la chlorophylle est visible dans le tableau ci-dessous.
| Position (C-n) | Hème b | Chlorophylle a | Remarques |
|---|---|---|---|
| C3 | $\ce{-CH=CH2}$ groupe vinyl |
$\ce{-CH3}$ groupe méthyle |
Changement hydrophobe |
| C7 | $\ce{-CH3}$ |
|
Différencie a/b |
| C8 | $\ce{-CH3}$ | $\ce{-CH2-CH3}$ groupe éthyle |
Chaîne allongée |
| C13 | $\ce{-CH3CH2COOH}$ | $\ce{-CH3}$ |
Perte de charge |
| C17 | $\ce{-CH3CH2COOH}$ groupe propionate |
Propionate estérifié avec phytol (chaîne hydrophobe et perte de charge) |
Lieu de fixation du phytol |
a. La grande différence repose sur les C17 et C18.
- En C13, le groupe propionate est remplacé par un groupe méthyle avec une perte de charge, i.e. propionate COO-.
- En C17, le groupe propionate, remplacé par une chaîne latérale longue et neutre, i.e. phytol estérifié, ce qui fait encore perdre une charge, sert d'ancre membranaire.
b. La chlorophylle est donc plus hydrophobe que l'hème, ce qui lui permet de s’ancrer solidement dans la membrane des thylakoïdes.
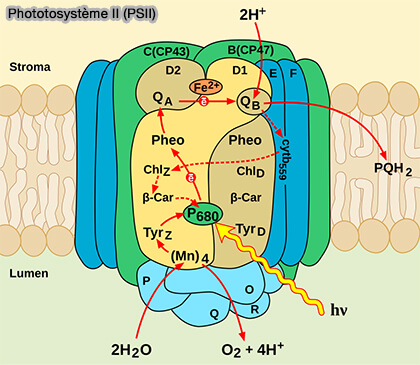
Photosystème II (PSII)
Le photosystème II (PSII) est une oxydoréductase qui catalyse la réaction :
$\ce{2H2O + 2 plastoquinones (PQ) + 2 photons}$ $\longrightarrow$ $\ce{O2 + 2 plastoquinols (PQH2)}$
Les protons sont libérés dans le lumen des thylakoïdes, contribuant directement au gradient électrochimique et à la force motrice des protons (PMF ou Δp).
1. La chlorophylle a 680 absorbe un photon et devient excitée (P680*).
(Figure : vetopsy.fr)
a. Son nom vient du fait qu'elle absorbe la lumière rouge à 680 nm.
$\ce{\text{P680} + photon}$ $\longrightarrow$ $\ce{\text{P680*}}$
b. Cet électron est absorbé par la phéophytine, une forme modifiée de chlorophylle.
$\ce{\text{P680*} + phéophytine}$
$\longrightarrow$ $\ce{\text{P680}^+ + phéophytine^-}$
Remarque : la chlorophylle récupère l'électron qu'elle a perdu lors de la photolyse (ou photodissociation) de l'eau ($\ce{H2O}$).
$\ce{H2O + 2photons}$ $\longrightarrow$ $\ce{2H+ + O2 + 2e-}$
2. La phéophytine, dérivée de la chlorophylle a avec un H+ à la place du Mg++ au centre du noyau porphyrine, transmet l'électron à une molécule de plastoquinone (PQ) pour la réduire en plastoquinol (PQH2).
La plastoquinone possède la même structure que l'ubiquinone (CoQ10), mais avec 9 unités isopréniques hydrophobes.
(Figure : vetopsy.fr d'après Kaidor)
a. La phéophytine- transmet l'électron à la plastoquinone liée (QA), plastoquinone liée de manière permanente à la protéine D2 de PSII, qui la transmet à une plastoquinone mobile (QB), liée temporairement à la protéine D1, qui réduit la plastoquinone (PQ) en plastoquinol (PQH2).
$\ce{Phéophytine^- + Q_A}$ $\longrightarrow$ $\ce{Phéophytine + Q_A^-}$
$\ce{Q_A^- + Q_B}$ $\longrightarrow$ $\ce{Q_A + Q_B^-}$
$\ce{Q_B^- + e- + 2H+}$ $\longrightarrow$ $\ce{PQH2}$
b. Si QA reçoit un électron, QB en reçoit un deuxième par un nouveau cycle de PSII.
$\ce{\text{P680*}}$ $\longrightarrow$ $\ce{phéophytine^-}$ $\longrightarrow$ $\ce{Q_A^-}$ $\longrightarrow$ $\ce{Q_B^-}$
$\ce{Q_B^- + e-}$ $\longrightarrow$ $\ce{Q_B^{2-}}$
c. Le plastoquinol (PQH2) quitte PSII pour rejoindre le complexe cytochrome b6f.
Remarque : PSII contient également un petit cytochrome b559 à deux sous-unités, i.e. PsbE et PsbF, qui ne participe pas directement au transfert d’électrons de l’eau vers la plastoquinone, mais joue :
- un rôle de stabilisation et de réparation du PSII,
- un rôle protecteur contre les dérivés réactifs de l'oxygène (ROS) hautement toxiques,
- un rôle régulateur pour éviter que des électrons ne remontent depuis la plastoquinone vers l’eau (réactions néfastes).
Son nom vient de la longueur d’onde d’absorption maximale de hème b qu’il contient, en état réduit, i.e. 559 nm.
Complexe cytochrome b6f
Le complexe cytochrome b6f (plastoquinol-plastocyanine réductase), i.e. EC 7.1.1.16 :
- transfère les électrons de la plastoquinone réduite (PQH2),
- pompe les protons du stroma du chloroplaste.
$\ce{2 plastocyanines (oxydées) + plastoquinol (PQH2) + 2H+_$stroma$}$
$\longrightarrow$ $\ce{2 plastocyanines (réduites) + plastoquinone (PQ) + 4H+_$lumen$}$
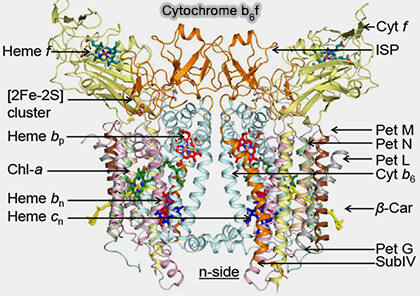
(Figure : vetopsy.fr d'après Cramer)
Par un mécanisme similaire au complexe III de la chaîne respiratoire, PQH2 transfère ses 2 électrons par le cycle Q.
$\ce{PQH2) }$ $\longrightarrow$ $\ce{PQ + 2H+ + 2e-}$
Première étape
1. PQH2, au site Qo transfère un électron à la plastocyanine, protéine cuprique (Cu++/Cu+), via un cluster fer-soufre [2Fe-2S] de type Rieske, qui le transfère à son tour au cytochrome f.
$\ce{e-}$ $\longrightarrow$ $\ce[2Fe-2S]$ $\longrightarrow$ $\ce{cytochrome f}$ $\longrightarrow$ $\ce{ plastocyanine (Cu^+)}$
L'hème f est un hème c modifié, avec un groupe formyle ($\ce{−CH=O}$) à la place d'un groupe méthyle ($\ce{-CH3}$) sur C2.
- Le potentiel redox du fer central est augmenté, i.e. +370 mV contre +220 à +320 mV, ce qui rend l'hème f plus favorable à l’acceptation d’électrons.
- Le groupe formyle est polarisé, ce qui a un rôle dans l’orientation de l'hème dans la poche du cytochrome f et dans les interactions avec la plastocyanine.
Remarque : une autre différence majeure est que le cytochrome c est mobile alors que le cytochrome f fait partie intégrante d'une protéine membranaire.
2. Parallèlement, l'autre électron est transmis, par le cytochrome b6, à l'ion ferreux (Fe++) de l'hème bL, puis de l'hème bH, à l'autre PQ au site Qi pour former une semiplastoquinone.
$\ce{e-}$ $\longrightarrow$ $\ce{Cyt b_L}$ $\longrightarrow$ $\ce{Cyt b_H}$ $\longrightarrow$ $\ce{SPQ}$
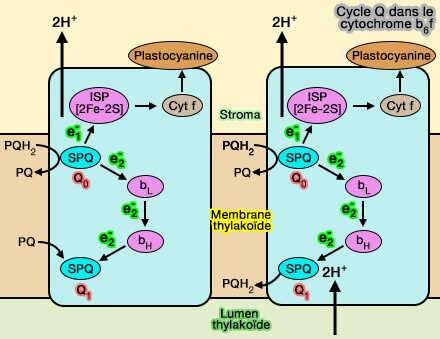
(Figure : vetopsy.fr)
L'hème b6 et l'hème b sont identiques, b6 désigne l'hème présent dans la photosynthèse et le chiffre 6 correspond à la masse moléculaire approximative du cytochrome b6, ≈ 24 kDa /4, nomenclature classique des cytochromes.
Deuxième étape
1. Un deuxième cycle similaire permet de transmettre à la semiplastoquinone du site Qi un deuxième électron pour reformer le plastoquinol (PQH2) qui repart vers le PSII pour recommencer le cycle.
$\ce{SPQ + e-}$ $\longrightarrow$ $\ce{SPQH2}$
2. Les 2 protons de PQH2 sont libérés dans le lumen et les 2 autres protons sont absorbés depuis le stroma, renforçant le gradient électrochimique.
Remarque : les réactions des deux complexes précédents créent un gradient de protons qui est utilisé par l'ATP synthase pour la synthèse de l'ATP.

L'ATP synthase est étudiée dans un chapitre spécifique.
Photosystème I (PSI)
Dans le photosystème I (PSI), la chlorophylle P700 est excitée par la lumière et oxydée.
$\ce{\text{P700} + photon}$ $\longrightarrow$ $\ce{\text{P700}^+ + e-}$
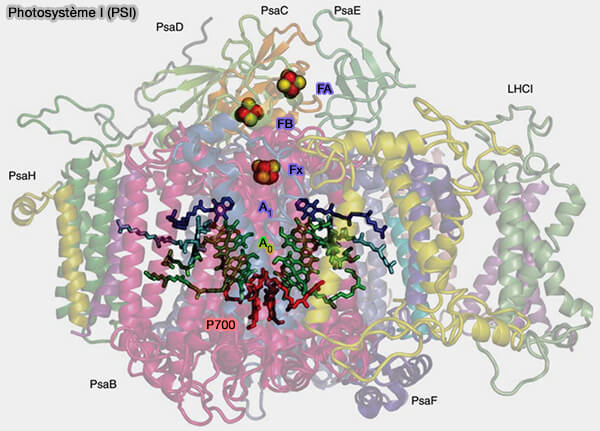
(Figure : vetopsy.fr d'après Nelson et Yocum)
1. L'électron de la chlorophylle 700 est transféré à une série de transporteurs.
a. Ce sont :
- la chlorophylle A0, chlorophylle a spéciale légèrement différente de P700, qui ne capte pas la lumière, mais accepte les électrons,
- la phylloquinone A1, similaire à la vitamine K1,
- des clusters fer-soufre [4Fe-4S], i.e. Fx ➞ FB ➞ FA,
- Fd, une ferrédoxine soluble, qui se trouve hors du PSI lui-même, libre dans le stroma.
Remarque : la ferrédoxine et la protéine de type Rieske sont toutes deux des protéines à centre fer-soufre [Fe-S], qui présentent plusieurs différences (
- la ferrédoxine est présente dans PSI.
- la protéine de type Rieske dans le cytochrome b6f.
b. Fd transporte l'électron de la ferrédoxine réduite vers la FNR (Ferredoxin–NADP+ réductase), i.e. EC 1.8.1.2, pour réduire NADP en NADPH.
$\ce{2NADP+ 2e^- + H+}$ $\longrightarrow$ $\ce{NADPH}$
2. L’électron perdu par P700+ est remplacé par celui apporté par la plastocyanine réduite (Cu+) qui provient du complexe b6f, i.e. plastocyanine qui reprend son état oxydé (Cu++) et circule librement dans le lumen pour recommencer un cycle.
$\ce{plastocyanine (Cu^+) + \text{P700}^+}$ $\longrightarrow$ $\ce{plastocyanine (Cu^{++}) +\text{P700}}$

P700 est donc l'accepteur final d'électrons de la chaîne de transfert d'électrons dépendante de la lumière.
Transfert d'électrons cyclique versus non cyclique
1. La phosphorylation non cyclique, mécanisme expliqué ci-dessus, utilise toute la chaine.
Photosystème II (PSII) ➞ plastoquinone ➞ cytochrome b6f ➞ plastocyanine ➞ Photosystème I (PSI) ➞ ferredoxine ➞ NADP ➞ NADPH
a. Elle produit :
- du NADPH,
- de l'O2,
- de l'ATP.
b. Les électrons perdus par la chlorophylle sont récupérés grâce à l'oxydation de l’eau (H2O), catalysée par le complexe oxygène-évolutif (OEC), i.e. Mn4O5Ca, aussi appelé complexe manganèse-calcium (The Oxygen-Evolving Center (OEC) of Photosystem II
$\ce{2H2O}$ $\longrightarrow$ $\ce{O2 + 4H+ + 4e-}$
- Ce complexe passe par plusieurs états d’oxydation successifs (S₀ ➞ S₄), appelés S-state (Oxygen-evolving photosystem II structures during S1–S2–S3 transitions 2024).
Tous les 4 flashs lumineux (4 excitations de P680), le complexe libère un O2.
c. La formation de NADPH est nécessaire pour alimenter la deuxième étape indépendante de la lumière ou cycle de Calvin.
2. Par contre, la phosphorylation cyclique utilise seulement :
Photosystème I (PSI) ➞ ferredoxine ➞ cytochrome b6f ➞ plastocyanine ➞ P700 de PSI
- Ce transfert cyclique ne forme que de l'ATP sans produire de NADPH ni d'O2.
- Ce cycle permet d'ajuster le rapport ATP/NADPH quand l’organisme a surtout besoin d’ATP.
Remarque importante : chez les plantes, cette production d'ATP lors de l'étape dépendante de la lumière ou phase claire, i.e. photophosphorylation, n'est :
- ni une phosphorylation au niveau du substrat,
- ni une phosphorylation oxydative bien qu'elle utilise l'ATP synthase et un transfert de protons, mais l'énergie initiale provient des photons et non pas des nutriments.
Étape indépendante de la lumière ou phase sombre
La deuxième étape est indépendante de la lumière, appelée aussi phase sombre et connue sous le nom de cycle de Calvin (ou Calvin-Benson-Bassham).

(Figure : vetopsy.fr d'après Allen et coll)
1. L’enzyme RuBisCO (ribulose-1,5-bisphosphate carboxylase/oxygénase), EC 4.1.1.39, enzyme-clé de la photosynthèse, capture le $\ce{CO2}$ de l’atmosphère.
- Il utilise le NADPH formé dans la première étape et libère des sucres à trois atomes de carbone, qui sont ensuite combinés pour former du saccharose et de l’amidon.
- L’équation globale des réactions indépendantes de la lumière est la suivante.
$\ce{3CO2 + 9ATP + 6NADPH + 6 H+}$ $\longrightarrow$
$\ce{C3H6O3-phosphate + 9 ADP + 8 Pi + 6 NADP+ + 3 H2O}$

Le détail des réactions chimiques est bien détaillé dans : Calvin cycle.
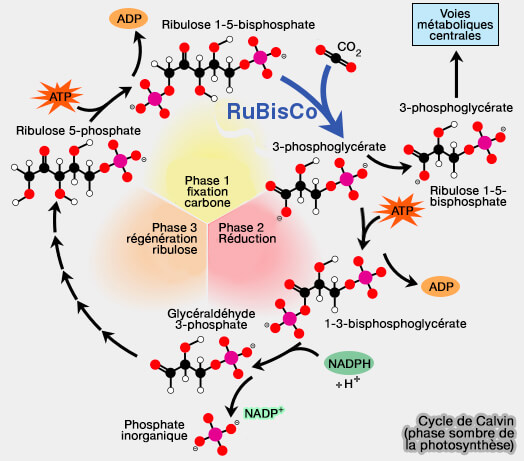
(Figure : vetopsy.fr)
2. Les composés intermédiaires, que l'on trouve dans le métabolisme du glucose, sont les suivants.
a. Pour la formation du glycéraldéhyde-3-phosphate (G3P) :
Ribulose-1,5-bisphophate (Ru5P) ➞ 3-phosphoglycérate (3PG) ➞
1,3-bisphosphoglycérate (1,3BPG) ➞ Glycéraldéhyde-3-phosphate (G3P)
b. Pour la formation du ribulose-1,5-bisphosphate :
Glycéraldéhyde-3-phosphate (G3P) ➞ Dihydroxyacétone phosphate (DHAP) ➞
Fructose-6-phosphate (F6P)➞ Érythrose-4-phosphate (E4P) ➞
xylulose-5-phosphate (Xu5P) ➞ Sédoheptulose-1,7 bisphosphate ➞
sédoheptulose-7-phosphate ➞ Ribose-5-phosphate (R5P) ➞
Ribulose-5-phosphate (Ru5P) ➞ Ribulose-1,5-bisphosphate (Ru1,5P)


