Bioénergétique
Chaîne respiratoire : chaîne de transfert d'électrons
Complexe IV ou cytochrome c oxydase (CcO)
Vue d'ensemble
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe IV ou cytochrome c oxydase (CcO), dernière enzyme de la chaîne de transport d’électrons de la chaîne respiratoire, réduit l'oxygène moléculaire (O2) en eau (H2O) et apporte de l'énergie à l'ATP synthase pour la synthèse de l'ATP.
(Vidéo : Harward Online)
Vue d'ensemble du complexe IV de la chaîne respiratoire

Vous pouvez lire : Oxygen Activation and Energy Conservation by Cytochrome c Oxidase (2018), article duquel est tiré l'essentiel de ce chapitre.
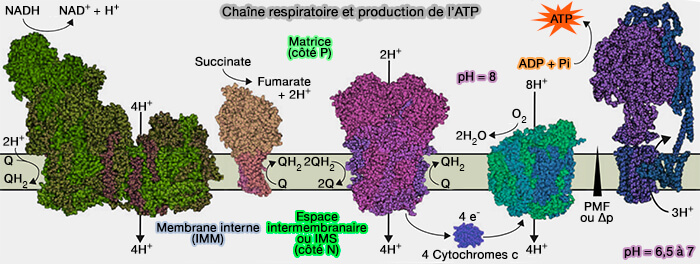
(Figure : vetopsy.fr)
1. Le complexe IV ou cytochrome c oxydase (CcO), i.e. EC 7.1.1.9, est une oxydoréductase membranaire de la chaîne respiratoire qui catalyse la réaction :
$\ce{4 cytochromes c (réduits\,à Fe^2+) + 8H+_$matrice$ + O2}$
$\longrightarrow$ $\ce{4 cytochromes c (oxydés\,à Fe^3+) + 4H+_$IMS$+ 2H2O}$
La réaction est très exergonique ($\Delta G_0'$ est égale -112 kj.mole-1) et permet la translocation de 4 protons de la matrice mitochondriale dans l'espace intermembranaire (IMS).
2. Le complexe IV est la dernière enzyme de la chaîne de transport d’électrons de la chaîne respiratoire.
a. Les complexes I, III et IV ont développé des mécanismes pour maximiser l'efficacité de la capture de la force motrice des protons (PMF ou Δp) de l'énergie libérée par leurs réactions d'oxydoréduction.
b. Dans le complexe IV, la réduction de l’O2 en H2O conserve une partie de l'énergie redox disponible.
- Il reçoit un électron de chacune des quatre molécules du cytochrome c pour les transférer à une molécule d’oxygène (O2) et à quatre protons, pour produire par réduction deux molécules d’eau (H2O).
- Cependant, dans chaque cycle catalytique complet, quatre protons supplémentaires sont transférés à travers la membrane mitochondriale interne (IMM), augmentant la différence transmembranaire du potentiel électrochimique des protons et donc la force motrice des protons (PMF ou Δp), que l’ATP synthase utilise ensuite pour synthétiser l’ATP (
voies de transfert des protons).
Structure générale du complexe IV
Le complexe IV des bactéries et des levures est composée que de 3 à 4 sous-unités.
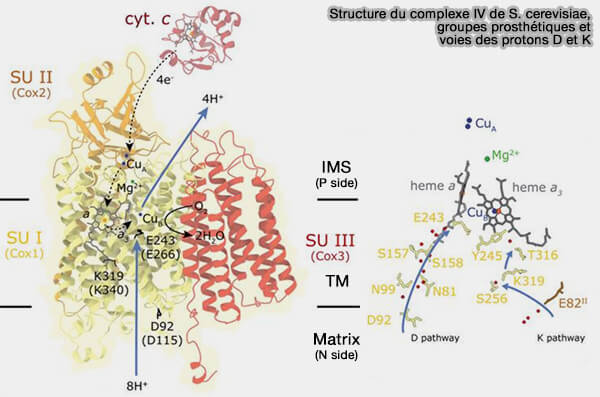
(Figure : vetopsy.fr d'après Brzezinski et coll)
Le complexe IV de mammifères est une grande protéine intégrale composée par plusieurs sous-unités.
Sous-unités catalytiques
Trois sous-unités catalytiques sont codées par l'ADN mitochondrial, très similaires à celles de la CcO bactérienne, et catalysent le transport de l'électron du cytochrome c vers l'oxygène et le pompage des protons.
1. Deux sous-unités contiennent des groupes prosthétiques métalliques.
a. La sous-unité I comprend :
- le centre actif dit binucléaire (BNC), i.e. cytochrome a3 à hème a3 à haut spin et CuB, distant seulement de 5 Å,
- le cytochrome a à hème a, à bas spin.
b. La sous-unité II contient CuA, i.e. le site d’entrée des électrons depuis le cytochrome c.
b. Les hèmes contiennent du fer (Fe++ ou Fe+++) selon l'état du cycle et les Cu du cuivre (Cu+ ou Cu++).
On note aussi la présence d'un ion magnésium (Mg++) qui sert de piège à protons.
2. La sous-unité III, bien qu'elle ne possède pas de centre redox, est aussi dite catalytique par abus de langage, car elle joue un rôle structurel essentiel à la catalyse globale.
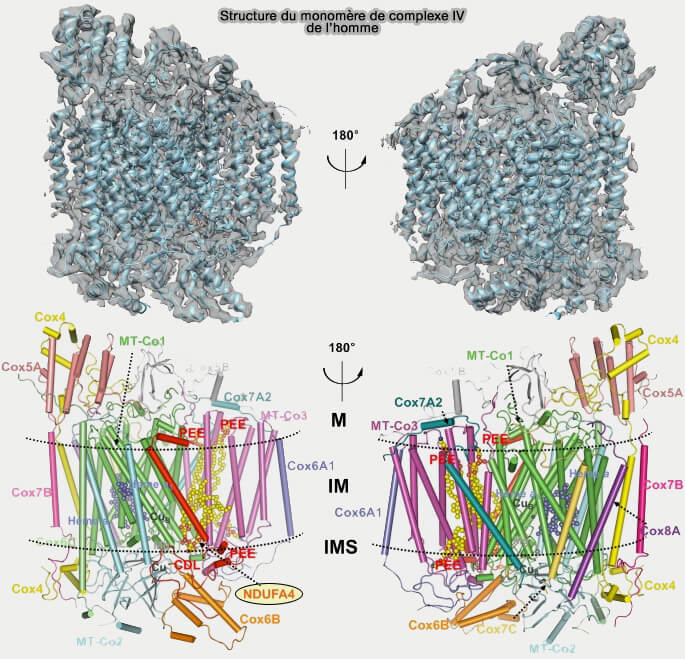
(Figure : vetopsy.fr d'après Brzezinski et coll)

Vous pouvez lire : The subunit composition and function of mammalian cytochrome c oxidase (2016). Une liste des sous-unités est consultable dans : The conserved subunits.
2. 10 ou 11 sous-unités protéiques retrouvées chez les mammifères sont codées par l’ADN nucléaire (The subunit composition and function of mammalian cytochrome c oxidase 2016).
a. Les dix sous-unités, i.e. IV, Va, Vb, VIa, VIb, VIc, VIIa, VIIb, VIIc, VIII, sont appelées ainsi suivant la diminution de leur masse moléculaire apparente,
Les sous-unités codées par le noyau sont essentiellement impliquées dans la régulation de la consommation d’oxygène et de la translocation des protons par la CcO, car leur élimination ou modification modifie l’activité et leur mutation provoque des maladies mitochondriales.
b. À l'heure actuelle, il semble que la sous-unité NDUFA4, qui faisait partie du complexe I, soit intégrée dans le complexe IV, d'où 14 sous-unités (Structure of the intact 14-subunit human cytochrome c oxidase 2018).
NDUFA4 est impliqué edans de nombreuses pathologies, en particulier dans le syndrome de Leigh et dans les cancers gastro-intestinaux (Mitochondrial respiratory chain component NDUFA4: a promising therapeutic target for gastrointestinal cancer 2024).
Remarque : diverses protéines et enzymes se lient à des sous-unités spécifiques de la CcO et modifient son activité, mais ces interactions sont réversibles, contrairement aux 13 sous-unités étroitement liées.
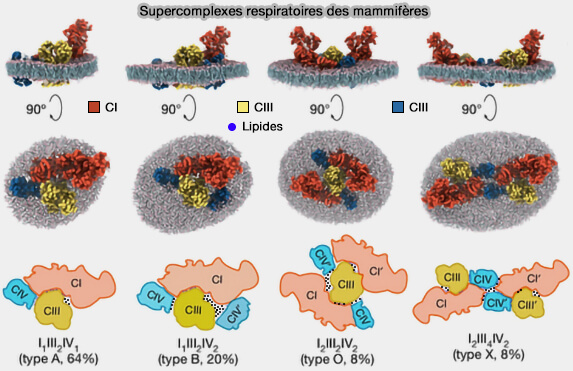
(Figure : vetopsy.fr d'après Zheng et coll)
3. De plus, la formation de supercomplexes avec d’autres complexes de phosphorylation oxydative s’est avérée être largement variable, comme par exemple I–II–III2-IV1, I–II–III2-IV2, I2–II–III2-IV2 et I2–II–III4-IV2 (High-resolution in situ structures of mammalian respiratory supercomplexes 2024).
4. La complexité régulatrice de la CcO est augmentée par la présence de 18 sites de phosphorylation des protéines, dont uniquement quelques sites de phosphorylation et quatre sous-unités codées nucléaires ont pu identifier une fonction spécifique.
Structure des sous-unités catalytiques et du site actif
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


