Bioénergétique
Chaîne respiratoire : chaîne de transfert d'électrons
Complexe III ou coenzyme Q-cytochrome c réductase
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

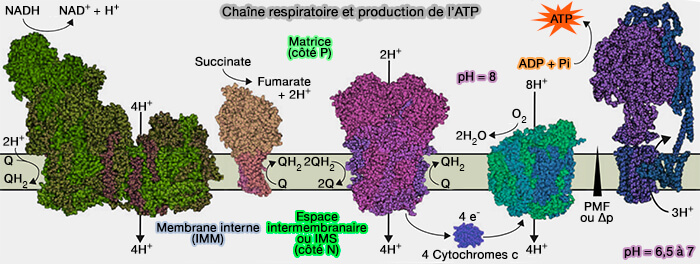
Le complexe III de la chaîne respiratoire ou coenzyme Q-cytochrome c réductase est une oxydoréductase membranaire qui permet le transfert de 2 électrons de l'ubiquinone (Q) ou coenzyme Q au cytochrome c et et le pompage de 4 protons de la matrice mitochondriale vers l'espace intermembranaire.
(Vidéo : Harward Online)
Vue d'ensemble du complexe III de la chaîne respiratoire

Vous pouvez lire plusieurs articles dans : An evolving view of complex II—noncanonical complexes, megacomplexes, respiration, signaling, and beyond (2023).
(Figure : vetopsy.fr)
1. Le complexe III ou coenzyme Q-cytochrome c réductase, i.e. EC 1.10.2.2, est une oxydoréductase membranaire de la chaîne respiratoire qui catalyse la réaction :
$\ce{QH_2 + 2 cytochromes c _1 (oxydés\,à Fe^3+) + 2H+_$matrice$}$
$\longrightarrow$ $\ce{Q + 2 cytochromes c_1 (réduits\,à Fe^2+) + 4H+_$IMS$}$
a. L'ubiquinol (QH2), la forme réduite de l'ubiquinone (Q) ou coenzyme Q, transmet ses deux électrons à la fois du complexe I et du complexe II.
(Figure : vetopsy.fr)
b. La réaction est exergonique ($\Delta G_0'$ est égale -37 kj.mole-1) et permet la translocation de 4 protons de la matrice mitochondriale dans l'espace intermembranaire (IMS) grâce aux 2 cytochromes c.
2. Chaque cytochrome c transporte un électron vers le complexe IV (Metalloproteins Containing Cytochrome, Iron–Sulfur, or Copper Redox Centers 2014).
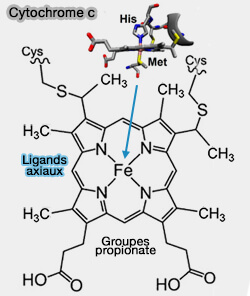
a. Le cytochrome c est une petite protéine d'une centaine d'acides aminés, à hème c de fer, qui peut s'oxyder (Fe+++ ou ion ferrique) ou se réduire (Fe++ ou ion ferreux).
- L’hème c est attaché à la protéine par deux séquences -Cys-x-x-Cys-His-, i.e. x étant tout acide aminé.
- Le résidu d’histidine dans la séquence conservée sert de ligand axial au fer héminique.
b. Il est hautement conservé et, par exemple, la cytochrome oxydase humaine réagit avec le cytochrome c du blé et, de plus, le potentiel redox de +0,25 V est le même pour toutes les molécules de cytochrome c étudiées.
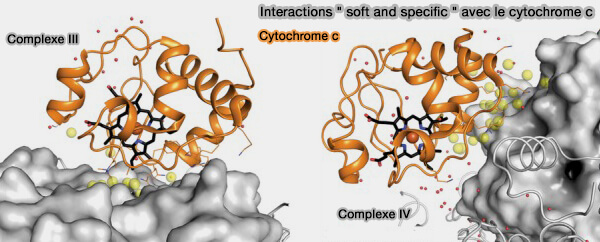
c. La structure cristalline du complexe a identifié une nouvelle classe d’interaction protéine-protéine dite " soft and specific ", i.e. " douce et spécifique ", qui n’avait pas été prédite auparavant (
(Figure : vetopsy.fr d'après Lyons et coll et Shimida et coll)
Remarque : En dehors de son rôle dans la chaîne respiratoire respiration, le cytochrome c joue un rôle clé dans l’apoptose.
Lorsqu’il est libéré dans le cytoplasme, il ctive la caspase 9 et éclenche la cascade apoptotique (

Il ne faut pas confondre le cytochrome c avec le cytochrome c1.
| Caractéristique | Cytochrome c | Cytochrome c1 |
|---|---|---|
| Localisation | Espace intermembranaire (IMS) | Complexe III (cytochrome bc1) |
| Rôle et mobilité |
Navette mobile qui transporte les électrons du complexe III vers le complexe IV | Fait partie intégrante du complexe III et transfère les électrons au cytochrome c |
| Fixation à la membrane | Soluble, flotte librement | Ancré dans la membrane |
| Nombre d'hèmes c | 1 lié covalemment comme tous les hèmes c |
1 (lié covalemment) |
| Taille | Plus petite (~12 kDa) | Plus grande |
| Apparition dans le chemin des électrons | En aval, i.e. navette vers le complexe IV | En amont , i.e. dans le complexe III |
Structure du complexe III
(Figure : vetopsy.fr)
1. La structure du complexe III, qui fonctionne comme un dimère, comprend plusieurs protéines, mais comparé aux autres transporteurs d'électrons, leur nombre peut être réduit à trois sous-unités redox (Metalloproteins Containing Cytochrome, Iron–Sulfur, or Copper Redox Centers 2014) :
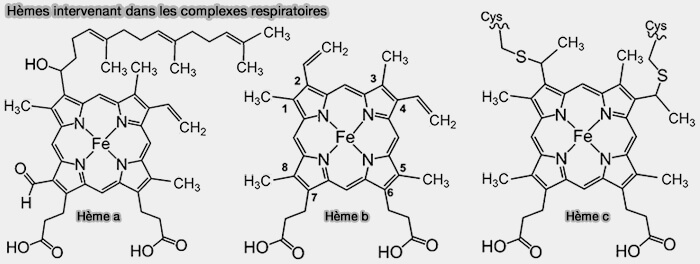
- un cytochrome c1,
- un cytochrome b avec deux types d'hème b, i.e. bL et bH, les deux cytochromes formant le complexe bc1,
- une protéine de type Rieske (ISP ou Iron Sulfur Protein) contenant un cluster fer-soufre [2Fe-2S].
Remarque : les différences entre ferrédoxine et protéines de type Rieske sont résumées dans un tableau.
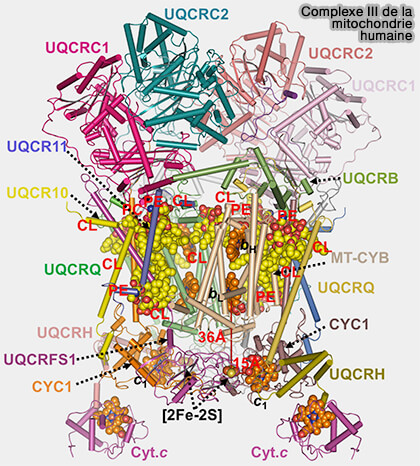
(Figure : vetopsy.fr d'après Guo et coll)
2. Toutefois, le complexe III peut atteindre onze sous-unités chez les animaux supérieurs (Complete Structure of the 11-Subunit Bovine Mitochondrial Cytochrome bc 1 Complex 1998).
Les sous-unités supplémentaires, appelées surnuméraires, qui n'ont pas de fonction cellulaire bien établie, mais qui sont vraisemblablement responsables de la stabilité du complexe, sont représentées par (
- 2 protéines centrales, i.e. QCR1/SU1 et QCR2/SU2,
- 6 protéines de faible poids moléculaire, i.e. QCR6/SU6 à QCR12/SU12.
3. Le complexe III peut être divisé en trois régions :
- la région localisée dans l'espace intermembranaire (IMS), avec cyt c1 et la sous-unité surnuméraire 8,
- la partie intermembranaire (TM) est composée de 13 hélices chez la mitochondrie bovine, i.e. 8 du cyt b, 1 du cyt c1 et 3 de l'ISP.
- la région matricielle, avec les sous-unités surnuméraires 1, 2, 6 et 9.

La structure est complexe et résumée dans les figures. Pour plus de précisions, vous pouvez lire : Structural Analysis of Cytochrome bc1 Complexes: Implications to the Mechanism of Function (2014) et Architecture of Human Mitochondrial Respiratory Megacomplex I2III2IV2 (2017)
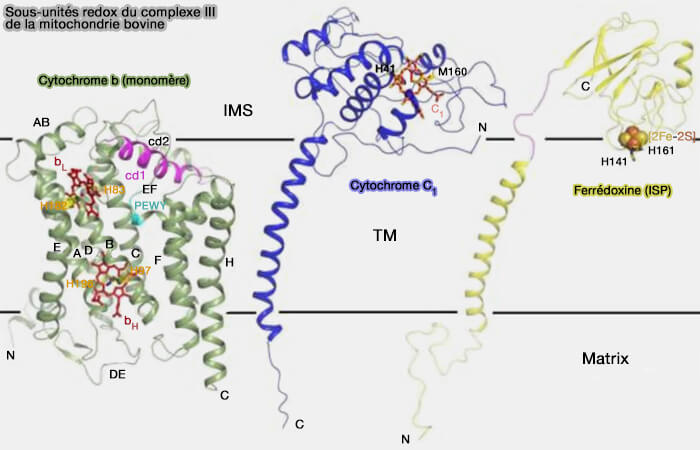
(Figure : vetopsy.fr d'après Xia et coll)
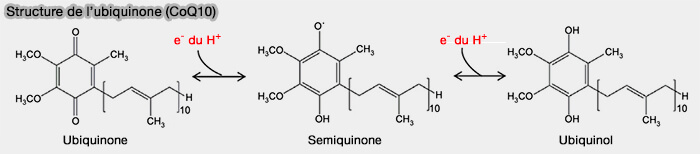
Mécanisme : cycle Q
Le mécanisme du complexe III est aussi appelé cycle Q, en référence à la coenzyme Q ou ubiquinone.
Chaque cycle libère quatre protons dans l'espace intermembranaire mitochondrial (IMM) en n'en absorbant que deux de la matrice mitochondriale.

Ce mécanisme contribue à la génération d'un gradient de concentration de protons à travers la membrane mitochondriale interne (IMM).
La réaction globale conduit également à :
- l'oxydation de 2 Q10H2 (ubiquinol) en Q10 (ubiquinone),
- la réduction de 1 Q10 en Q10H2,
- la réduction de 2 Cyt c.
Première étape du cycle Q
1. La première étape de la réaction s'effectue comme suit.
(Figure : vetopsy.fr)
a. Une première molécule de QH2 (ubiquinol) se lie au site Qo (o pour outer) du cytochrome b tandis que une autre ubiquinone Q se lie au site Qi (i pour inner ou 1).
b. QH2 liée au site Qo cède son premier électron à [2Fe-2S], qui le cède à l'hème c1 du cytochrome c1 pour réduire le cytochrome c.

Si le cytochrome c1 fait partie intégrante du complexe III, i.e. y est lié, le cytochrome c peut se déplacer dans l’espace intermembranaire de la mitochondrie pou livrer son électron au complexe IV.
c. Parallèlement, QH2 cède son deuxième électron à l'ion ferreux (Fe++) de l'hème bL, i.e. L pour low (potentiel bas, ~ -0,1 V, donneur d'électrons), qui le cède à son tour à l'hème bH, i.e. H pour high, (potentiel haut ~ +0,03 V, accepteur d'électron), tous deux dans le du cytochrome b, qui le transfère à l'ubiquinone liée (potentiel de +0,045 V-) au site Qi pour former un radical semiquinone (SQ), i.e. électron lié à une quinone.
$\ce{QH_2 + Q + cytochrome c_1(oxydé\,à Fe^3+)}$
$\longrightarrow$ $\ce{Q + Q^- + cytochrome c_1 (réduit\,à Fe^2+) + 2H+_$IMS$}$
2. Cette première étape a pour effet de libérer :
a. dans l'espace intermembranaire mitochondrial (IMS), deux protons H+ et un cytochrome c réduit,
b. dans la membrane mitochondriale interne (IMM), une ubiquinone (Q) issue de l'oxydation de l'ubiquinol initialement lié au site Qo.
Le radical semiquinone demeure lié au site Qi.
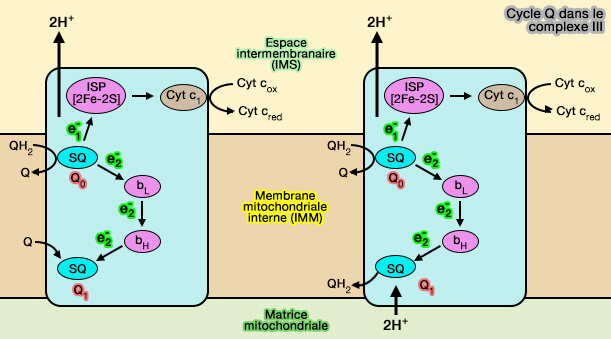
(Figure : vetopsy.fr)
Remarque : lors de cette étape, une fuite d'électrons vers l'oxygène ($\ce{O2}$) peut provoquer la formation de superoxyde $\ce{O2^•-}$ et de dérivés réactifs de l'oxygène (ROS) hautement toxiques (Modelling mitochondrial ROS production by the respiratory chain 2019).
- Cette fuite est substantielle quand le complexe bc1 est bloqué par des inhibiteurs spécifiques comme l’antimycine A ou lorsque la chaîne de transfert devient trop réduite.
- La fuite d’électrons se produit principalement au niveau du site Qo en augmentant la concentration de semiquinone qui réagit avec l'oxygène pour former des superoxydes.
- Le superoxyde produit sur le site Qo peut être libéré à la fois dans la matrice mitochondriale et dans l’espace intermembranaire, où il peut ensuite atteindre le cytosol.
Deuxième étape du cycle Q
1. La deuxième étape de la réaction s'effectue comme suit.
a. Une seconde molécule de QH2 (ubiquinol) se lie au site Qo du cytochrome b.
b. c. Q1H2 cède, comme à l'étape précédente, ses deux électrons, excepté que le deuxième est cédé par l'hème bH au radical semiquinone SQ de la première étape.
Cette dernière réaction conduit à la formation d'une molécule de QH2 (ubiquinol) sur le site Qi par absorption de deux protons H+ de la matrice mitochondriale.
$\ce{QH_2 + Q^- + cytochrome c_1 (oxydés\,à Fe^3+)}$
$\longrightarrow$ $\ce{Q + QH_2 + cytochrome c_1 (réduits\,à Fe^2+) + 2H+_$IMS$}$
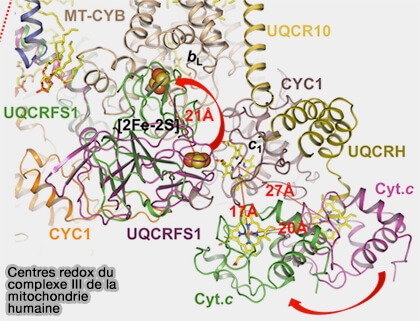
(Figure : vetopsy.fr d'après Guo et coll)
2. Cette deuxième étape a pour effet de libérer :
a. dans l'espace intermembranaire mitochondrial (IMS), deux protons H+ et un cytochrome c réduit,
b. dans la membrane mitochondriale interne (IMM) :
- une ubiquinone (Q) issue de l'oxydation de l'ubiquinol initialement lié au site Qo,
- une molécule de QH2 (ubiquinol) issue de la réduction de l'ubiquinone initialement liée au site Qi.
3. L'expression nette est donc :
$\ce{QH_2 + 2 cytochromes c _1 ((oxydés\,à Fe^3+) + 2H+_$matrice$}$
$\longrightarrow$ $\ce{Q + 2 cytochromes c_1 (réduits\,à Fe^2+) + 4H+_$IMS$}$
Complexe IV de la chaîne respiratoire
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


