Bioénergétique
Réactions d'oxydoréduction
Potentiel d'oxydoréduction (potentiel redox)
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le potentiel d'oxydo-réduction (ou potentiel redox) d'un système d'oxydo-réduction est la différence de potentiel E qui s'établit entre une électrode plongeant dans ce système et une électrode standard de référence dite à hydrogène.
Calcul du potentiel redox
1. Une réaction d'oxydoréduction est donnée par la formule :
$\ce{Réd}$ $\leftrightharpoons$ $\ce{Ox + ne-}$
On peut mesurer le potentiel redox (E), i.e. la richesse en électron d'un système, en utilisant une électrode standard de référence dite à hydrogène.
$\ce{RH2}$ $\leftrightharpoons$ $\ce{2H+ + 2e-}$
a. Cette électrode est constituée d'une lame de platine recouverte de noir de platine, qu'on sature d'hydrogène gazeux par barbotage, sous une pression d'une atmosphère, et plongeant dans une solution molaire en ions H+, i.e. pH=0, à une température de 25°C.

Par définition, dans ces conditions, son potentiel est égal à zéro, i.e. équilibre entre H2 et 2H+.
b. Un tel pH n'est jamais rencontré dans la matière vivante où les réactions ont lieu à des pH voisins de 7.
- C'est pourquoi certains utilisent, par convention, E', potentiel rédox à pH = 7 et à 25° C (298° K).
- Dans ce cas, l'électrode à hydrogène acquiert un potentiel E'o de - 0,42 V au lieu de 0.
2. La valeur du potentiel redox est donnée par la formule de Nernst adaptée, en remplaçant le logarithme népérien par le logarithme de base 10 plus facile à utiliser :
$E \approx E^o + \dfrac{RT}{zF} log\dfrac{Réd}{Ox}$
$E^o$ est le potentiel de demi-réduction, ou potentiel normal d'oxydoréduction du système, i.e. valeur de E lorsque $Red = Ox$ lorsque le milieu renferme autant de forme réduite que de forme oxydée.
- Eo est d'autant plus faible que le système redox étudié est plus riche en électrons, donc plus réducteur.
- Ainsi, lorsque deux systèmes redox seront en présence, celui qui aura l'Eo le plus bas réduira celui dont l'Eo sera plus élevé, qui sera alors oxydé.
Exemple : pile d'oxydoréduction
Pile Daniell
On réalise un circuit comportant dans chaque bécher un système redox en solution dans lequel plonge une électrode.
- Chaque système est appelé demi-pile.
- Les demi-piles sont reliées par un pont salin.
1. On prendra comme exemple la pile Daniell.
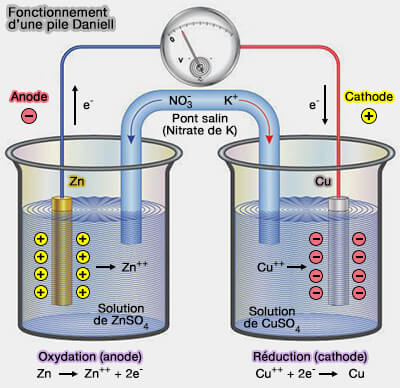
(Figure : vetopsy.fr)
a. La borne (-) de la pile correspond à l'anode de Zn plongeant dans une solution de sulfate de zinc dans laquelle se produit la réaction d'oxydation qui va fournir les électrons.
$\ce{Zn}$ $\leftrightharpoons$ $\ce{Zn++ + 2e-}$.
b. La borne (+) de la pile correspond à la cathode de cuivre plongeant dans une solution de sulfate de cuivre dans laquelle se produit la réduction qui va consommer les électrons.
$\ce{Cu++ + 2e}$ $\leftrightharpoons$ $\ce{CU}$
c. Plus généralement, le système le plus riche en électrons cédera, par ce circuit, ses électrons au système le plus pauvre.
Il s'établira entre les 2 électrodes une différence de potentiel (E), d'autant plus élevée que le milieu pauvre est plus pauvre en électrons.
2. Pour assurer l'équilibre des charges électriques, il faut relier les deux solutions à l'aide d'un pont salin, qui contient un électrolyte inerte du point de vue électrochimique et permet donc la conduction d'un courant électrique entre les deux demi-piles sans que les deux solutions se mélangent.
Dans le cas de la pile Daniell :
- deux ${NO_3^-}$ rééquilibrent la solution de sulfate de zinc.
- deux ${K^+/}$ traversent le pont salin pour rééquilibrer la solution de sulfate de cuivre.
3. La pile fournit du courant continu (
Transfert d'électron et potentiel redox
Pourquoi le transfert s'effectue dans ce sens ?
1. Au niveau de l'anode, $\ce{Zn}$ $\leftrightharpoons$ $\ce{Zn++ + 2e-}$.
L'équation de Nerst nous donne :
$E_{Zn} \approx E^o(Zn^{++}/Zn) + \dfrac{0,59}{2} log \dfrac{Zn^{++}}{C^0}$ avec :
- $E^o(Zn^{++}/Zn)=-0,76V$ comme potentiel standard,
- d'où, le potentiel de l'électrode Zn est $E_{Zn} \approx -0,76V$.
2. Au niveau de la cathode, $\ce{Cu++ + 2e}$ $\leftrightharpoons$ $\ce{CU}$.
On reprend la même équation en remplaçant ${Zn}$ et $Zn^{++}$ par ${Cu}$ et $Cu^{++}$ avec :
- le potentiel standard $E^0(Cu^{++}/Cu)=+0,34V$
- d'où, le potentiel de l'électrode Cu est $E_{Cu} \approx +0,34V$
3. On peut donc prédire que le zinc, i.e. $E_{Zn}= -0,76V$, va transmettre ses électrons au cuivre, i.e. $E_{Cu}= +0,34V$, suivant la réaction :
$Zn + Cu^{++}$ $\longrightarrow$ $Zn^{++} + Cu$
a. Les électrons libérés par l'anode, i.e. pôle (-) se dirigent alors vers la cathode, i.e. pôle (+) en créant un courant dans le circuit.
- Ce courant est conventionnellement positif, du pôle (+) ➞ pôle (-), alors que les électrons se dirigent du pôle (-) vers le pôle (+) car ils sont chargés négativement.
- La différence de potentiel aux bornes de la pile est :
$U= E_{Cu} (cathode) - E_{Zn} (anode) \approx +0,34 - (-0,76) \approx 1,10V$
b. La constante d'équilibre K de cette réaction est de l'ordre de 1037.
Tant que le quotient de cette réaction est inférieur à K, la réaction évolue dans le sens direct, i.e. dans le sens de la consommation des réactifs.

Une liste de potentiels redox, i.e. E0 est consultable dans un tableau.
Systèmes Redox rencontrés en biologie

Vous pouvez lire : Design and fine-tuning redox potentials of metalloproteins involved in electron transfer in bioenergetics (2016).
Vue d'ensemble
On peut distinguer plusieurs systèmes redox en biologie.
1. Certains de ces systèmes sont directement actifs comme les cytochromes Fe+++ / Fe++.
2. D'autres n'interviennent dans les oxydoréductions qu'en présence de déshydrogénase et d'accepteur d'électrons de Eo voisins qu'on appelle centres redox comme dans la chaîne respiratoire.
| Réducteur (donneur e-) | Oxydant (accepteur e-) | E'o |
|---|---|---|
| Pyruvate | Éthanal | - 0,60 |
| 3-phospho-D-glycérate (3PG) | Glycéraldéhyde-3-phosphate (GADP) | - 0,57 |
| 2 H+ | H2 (électrode à hydrogène) | - 0,42 |
| Xanthine | Hypoxanthine | - 0,41 |
| Acide urique | Xanthine | - 0,35 |
| Glutathion | Glutathion-H2 | - 0,34 |
| NAD+ | NADH | - 0,31 |
| Oxalosuccinate | Isocitrate | - 0,29 |
| Acétoacétate | β-D-hydroxybutyrate (BHB) | - 0,28 |
| Éthanal | Éthanol | - 0,19 |
| Pyruvate | Lactate | - 0,18 |
| Riboflavine (vit B2) | Dihydroriboflavine | - 0,18 |
| Oxaloacétate | Malate | - 0,17 |
| Cystine | Cystéine | - 0,14 |
| FMN | FMNH2 | - 0,12 |
| FAD | FADH2 | - 0,06 |
| α-cétoglutarate | Glutamate | - 0,05 |
| Pyruvate | Alanine | -0,04 |
| Fumarate | Succinate | - 0,01 |
| Cytochrome b (Fe+++ / Fe++) | + 0,02 | |
| Acide déhydroascorbique | Acide ascorbique (Vit C) | + 0,14 |
| Cytochrome c (Fe+++ / Fe++) | + 0,26 | |
| Cytochrome a (Fe+++ / Fe++) | + 0,29 | |
| Cytochrome a3 (Fe+++ / Fe++) | + 0,55 | |
| O-- | 1/2 O2 (électrode à O) | + 0,81 |
Potentiel Redox d'un milieu biologique
Dans les milieux biologiques et notamment à l'intérieur des cellules où se déroulent les réactions complexes du métabolisme, on trouve plusieurs systèmes redox qui peuvent être réduits à un système simple.
1. Or, le potentiel intracellulaire normal possède de faibles variations étroitement liées au degré d'oxygénation des cellules :
- E'o = - 0,05 volt, dans les cellules normalement oxygénées, i.e. aérobies,
- E'o = - 0,20 volt, dans les cellules privées d'oxygène, i.e. anaérobies, milieu anoxybiotique (fermentations).
2. Dans ces conditions, les systèmes redox dont le E'o est :
- supérieur à -0,05 V auront tendance à capter des électrons, donc de l'énergie, de l'énergie dans le milieu, i.e. subir une réduction,
- inférieur à -0,20 V pourront fournir de l'énergie sous forme d'électrons au milieu, i.e. subir une oxydation,
- compris entre -0,05 et -0,20 V évolueront vers des formes oxydées en milieu aérobie et réduites en milieu anaérobie comme dans des milieux de fermentation ou des animaux en état d'anoxie.
Par exemple, dans un muscle soumis à un travail prolongé où se produit une anoxie relative, E'o s'abaisse vers -0,20 V (
$\ce{Pyruvate + NADH + H+}$ $\leftrightharpoons$ $\ce{L-lactate + NAD+}$
- Le système pyruvate ➞ lactate, dont le E' est -0,18 V, se trouvera à l'état réduit, i.e. il y aura accumulation d'acide lactique.
- Lors de la récupération, E'o remontera à -0,05 V et le système précédent se trouvera inversé, i.e. l'acide lactique sera progressivement résorbé.
Retour aux réactions d'oxydoréduction
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


