Cofacteurs
Cofacteurs d'oxydoréduction
Hèmes et cytochromes: structure
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Un hème est un groupe prosthétique (non protéique) constitué d’un anneau porphyrine qui entoure un atome de fer (Fe), un cytochrome est une protéine qui contient un hème comme groupe prosthétique.
Hèmes
Structure générale
Un hème est un groupe prosthétique constitué d’un anneau porphyrine qui entoure un atome de fer (Fe) qui joue un rôle essentiel dans :
- le métabolisme respiratoire par l'hémoglobine dans les hématies, d'où le nom de porphyrine érythrocytaire,
- la chaîne respiratoire et la photosynthèse.
(Figure : vetopsy.fr)
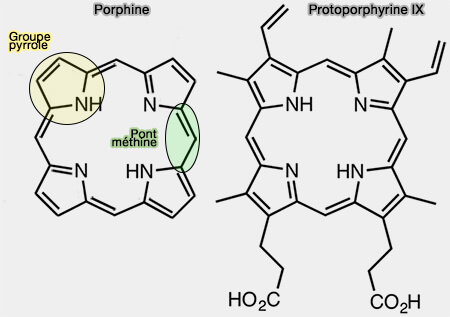
1. Les porphyrines sont des structures pigmentées, du grec porphura, violet, qui fournissait des pigments dans l'antiquité, le pourpre, à partir d'un coquillage, le murex.
- Une porphyrine est un macrocycle hétérocyclique constitué de quatre sous-unités pyrrole jointes sur les carbones alpha par quatre ponts méthine, i.e. (=CH−).
- Le macrocycle est donc complètement aromatique, à l'inverse des noyaux corrine et chlorine.
a. La protoporphyrine IX (PPIX) est le précurseur d’autres composés comme l’hème b (hémoglobine) et la chlorophylle (Nomenclature of tetrapyrroles 1986).
- Le terme " proto " fait référence au fait que les atomes d'hydrogène externes dans les quatre cycles pyrroliques sont remplacés par d'autres groupes fonctionnels.
- Les différentes porphyrines sont classées selon la disposition de leurs groupes latéraux, i.e. méthyle (M), vinyle (V), propionate (P)… sur ces cycles.
- Le chiffre IX indique simplement que c’est le neuvième isomère connu et classifié et les chaînes latérales sont disposées selon le motif MV–MV–MP–PM autour du cycle tétrapyrrolique, aux positions suivantes : c2, c3 – c7, c8 – c12, c13 – c17, c18.
b. La biosynthèse des porphyrines est expliquée dans Wikipedia et la réaction globale est la suivante :
$\ce{8 Glycines + 8 Succinyl-CoA + Fe++ + O2}$ $\longrightarrow$ $\ce{Hème B + 8 CO2 + 8 CoA + autres sous-produits}$
- La première étape de la synthèse de l'hème comporte une combinaison de la glycine avec l'acide succinique, qui est activé sous forme de succinyl-CoA, qui provient le plus souvent du propionyl-CoA, pour former l'acide δ-aminolévulinique (dALA).
- Ce processus explique l'anémie observée au cours de la carence en acide pantothénique.
Biosynthèse de l'hème B
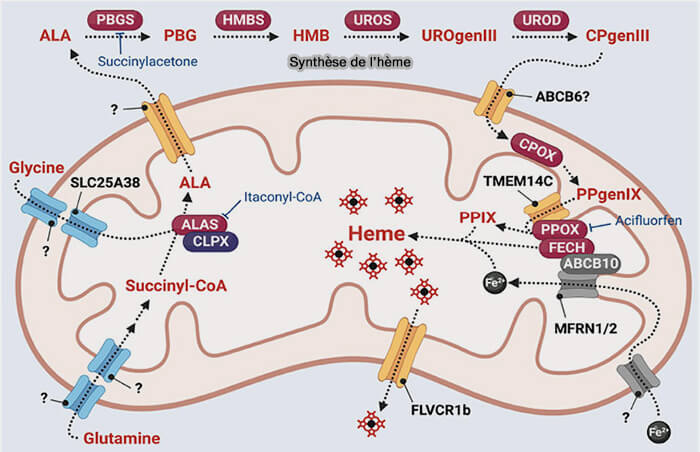
(Figure : vetopsy.fr d'après Yien et Perfetto)
Dans les hèmes, les porphrines se lient à un atome de Fer (Fe) et forme un coeur MN4 plan.
Un coeur MN4 est un site catalytique ou centre actif, i.e. M pour métal, Fe, Co, Ni, Mn…, N4 pour les quatre azotes coordonnant le métal.
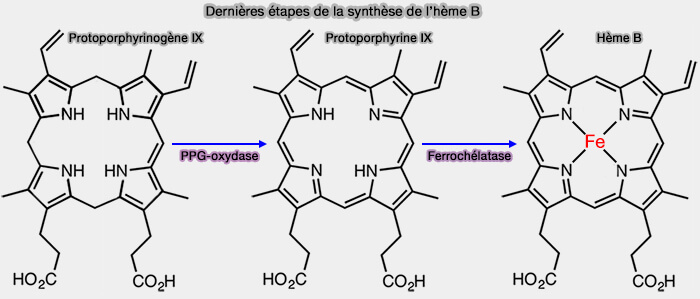
1. L'hème B est formé par l'insertion directe du fer dans la protoporphyrine IX par la ferrochélatase (EC 4.99.1.1), enzyme localisée, chez les eucaryotes, dans la face interne de la membrane interne mitochondriale (IMM), très spécifique pour l’ion ferreux (Fe++).
$\ce{Protoporphyrine IX + Fe++}$ $\longrightarrow$ $\ce{Hème B+ 2 H+}$
La réaction n'a pas besoin d'ATP comme la magnésium chélatase pour obtenir la chlorophylle.
a. Cette réaction nécessite la forme oxydée de la protoporphyrine (IX) qui doit former un cycle aromatique, cycle qui doit remplir quatre conditions :
- formation d'un cycle fermé,
- les atomes du cycle sont tous dans le même plan,
- alternance de liaisons simples et doubles, donc un nuage d’électrons délocalisés,
- suivre la règle de Hückel, i.e. le cycle contient (4n + 2) électrons π délocalisés, n représente un nombre entier d’orbitales moléculaires π remplies, i.e. le nombre de " paires " d’électrons π délocalisés, moins 1.
Remarque : les électrons π (pi) sont les électrons présents dans les doubles et triples liaisons (liaisons π).
- Si les liaisons sont isolées, séparées par des liaisons simples non conjuguées, ils restent localisés.
- Si le système est conjugué, alternance de liaisons simples et doubles comme dans la protoporphyrine (IX) lors les électrons π sont délocalisés sur tout le cycle.
b. Par exemple, pour le benzène, n = 1, donc 4n + 2 = 6 électrons π, la porphyrine, 18 électrons π, i.e. 8 pour les quatre double liaisons (1 par cycle), 8 pour les 4 paires d'électrons libres d'azote et 2 pour les ponts méthine.
- Par contre, le chiffre de 18 électrons π paraît faible vu le nombre de doubles liaisons (11) dans la protoporphyrine (IX).
- Mais, il faut bien comprendre que sa structure réelle n’a pas de doubles liaisons fixes, mais forme un système conjugué délocalisé, i.e. Les électrons π sont répartis sur tout le macrocycle et ne sont pas attachés à une double liaison en particulier.
(Figure : vetopsy.fr)
2. Le protoporphyrinogène IX, précurseur réduit de la protoporphyrine (IX) par l'action de la PPG oxydase, (EC 1.3.3.4) est un cycle non aromatique.
$\ce{Protoporphynogène IX + 3 O2}$ $\longrightarrow$ $\ce{Protoporphyrine IX + 3 H2O2}$
3. L’hème B est la forme de base de la synthèse des autres hèmes.

Le métabomlsme des hèmes est complexe et vous pouvez lire : A Recap of Heme Metabolism towards Understanding Protoporphyrin IX Selectivity in Cancer Cells (2022) et Regulation of Heme Synthesis by Mitochondrial Homeostasis Proteins (2022).
Remarque : un comparatif entre les structures de l'hème b, i.e. porphryrine, et de la chlorophylle, i.e. chlorine, est étudié dans un tableau.
Pigmentation des hèmes
Les propriétés de résonance de la double liaison conjuguée dans l'hème, i.e. quatre groupes pyrroliques et l'atome de fer au centre, déterminent sa capacité à absorber la lumière visible et ainsi à jouer son rôle de pigment.
(Figure : vetopsy.fr)
1. Les hèmes forment des systèmes conjugués étendus, i.e. doubles liaisons alternées avec des laisons simples, ce qui système permet aux électrons π (pi) de se délocaliser sur l’ensemble de la molécule, ce qui abaisse l’écart d’énergie entre les niveaux électroniques (
- La molécule peut absorber la lumière dans le spectre visible, typiquement dans les longueurs d’onde bleu-vert, i.e. essentiellement entre 400 et 600 nm.
- Comme le rouge est situé au-dessus de 600 nm, l'hème ne l’absorbe pas et il est réfléchi, ce qui donne par exemple la couleur du sang ou de la viande par exemple.
2. L’atome de fer au centre du noyau porphyrinique :
- modifie la distribution électronique de la porphyrine, influençant ainsi les longueurs d’onde de lumière absorbées et donc la couleur,
- interagit avec d’autres molécules, ce qui peut changer la couleur (
myoglobine et couleurs de la viande).
Différents hèmes
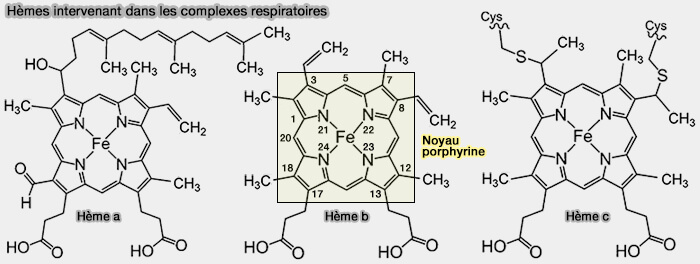
(Figure : vetopsy.fr)
1. Les hèmes diffèrent par les groupes chimiques liés au cycle porphyrine.
| Type d'hème | Hème A | Hème B | Hème C |
|---|---|---|---|
| Formule chimique |
$\ce{C49H56O5N4Fe}$ | $\ce{C34H32O4N4Fe}$ | $\ce{C34H32O4N4Fe}$ |
| Groupe fonctionnel en C3 |
$\ce{(-CH(OH)CH2)_3}$ terpénoïde (farnésyle) |
$\ce{-CH=CH2}$ groupe vinyl |
$\ce{-CH(S-cystéine)-CH3}$ Thioéther cystéinyl-hémique |
| Groupe fonctionnel en C8 |
$\ce{-CH2}$ groupe méthylène |
$\ce{-CH2}$ | $\ce{-CH(S-cystéine)-CH3}$ |
| Groupe fonctionnel en C13 et C17 |
$\ce{-CH3CH2COOH}$ groupe propionate |
$\ce{-CH3CH2COOH}$ | $\ce{-CH3CH2COOH}$ |
| Groupe fonctionnel en C18 |
$\ce{-CH=O}$ groupe formyle |
$\ce{-CH3}$ groupe méthyle |
$\ce{-CH3}$ |
Remarque : l'hème 0 d'Escherichia coli est quasi identique à l'hème a, mais avec un groupe méthyle en C8.
2. Le type le plus courant est l'hème B, puis l'hème A et l'hème C.
Il existe d'autres hèmes, i.e. I, M, D et S qui sont dérivés de l'hème B (
Remarque sur la nomenclature : les hèmes isolés sont communément désignés par des lettres majuscules, tandis que les hèmes liés aux protéines sont désignés par des lettres minuscules.
- Le cytochrome a fait référence à l'hème A en association spécifique avec la protéine membranaire formant une partie de la cytochrome c oxydase du complexe 3.
- Dans la pratique, majuscule et minuscule sont souvent interchangeables.
| Type d'hème | Hème A | Hème B | Hème C |
|---|---|---|---|
| Potentiel redox | +250 à +370 mV | -100 à +50 mV | +220 à +320 mV |
| Exemples de protéines | Complexe IV/cytochrome c oxidase (uniquement) | ||
| Fonction principale |
|
|
Transfert d'électrons |
| Particularités |
|
Le plus courant, stable, polyvalent |
|
Atome de fer et coordination
L'atome de fer peut établir jusqu'à 6 liaisons de coordination.
1. Quatre liaisons concernent les atomes d’azote de la porphyrine.
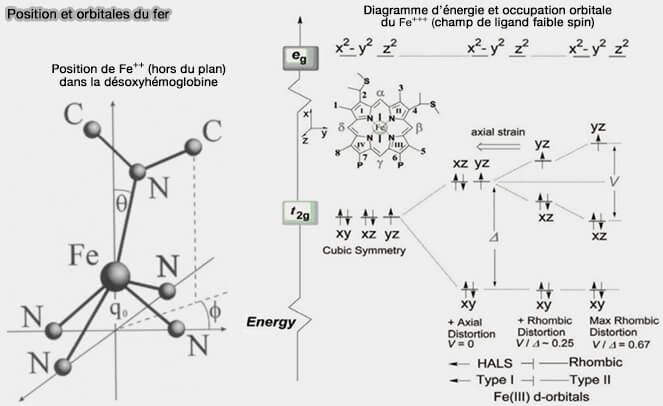
(Figure : vetopsy.fr d'après Schweitzer-Stenner)
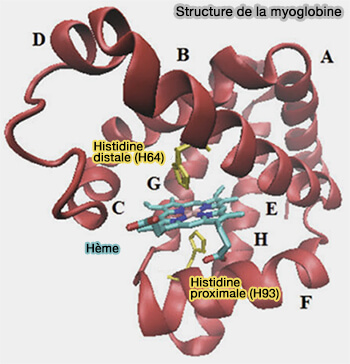
2. La liaison située sous le plan de l'hème est assurée avec un acide aminé qui dépend du type de protéine envisagé.
| Type de protéine hémique | Acide aminé lié au fer (ligand proximal) | Atome donneur de la liaison | Remarques |
|---|---|---|---|
| Myoglobine | Histidine proximale | Azote (N) de l'imidazole | Très conservé |
| Hémoglobine | Histidine proximale | Azote (N) de l'imidazole | Identique à la myoglobine |
| Cytochrome P450 | Cystéine | Soufre (S) du thiol |
|
| Cytochrome b5 | Histidine (parfois 2) | Azote (N) de l'imidazole | Parfois 2 histidines (sup. et inf.) |
| Cytochrome c | Méthionine (parfois histidine) |
Soufre (S) du thioester ou azote (N) |
Liaison parfois mixte avec histidine (His–Fe–Met) |
| Peroxydases | Histidine proximale | Azote (N) |
|
| Catalases | Histidine (souvent) | Azote (N) | Peut être associée à une tyrosine ou une asparagine en coordination secondaire |
3. La liaison au-dessus du plan peut être :
libre temporairement quand il est :
- en attente d'un ligand à fixer comme dans l'hémoglobine, i.e. O2, CO2, NO,
- dans une étape intermédiaire d’une réaction enzymatique, comme dans le cytochrome P450 après avoir libéré H2O ou O2, i.e. étapes pentacoordonnées transitoires essentielles pour l’activation de l’oxygène,
- dans une forme inactive ou désaturée comme dans les peroxydases après formation d’un état ferryl (Fe4+
occupée par une petite molécule ou un acide aminé.
| Type de protéine | 6ème liaison (au-dessus du fer) |
Type de ligand | Remarques |
|---|---|---|---|
| Myoglobine | Dioxygène (O2) | Molécule | Liaison réversible, permet le stockage d’O2 |
| Hémoglobine | Dioxygène (O2) | Molécule | Liaison réversible et coopérative, transport d’O2 |
| Carboxyhémoglobine | Monoxyde de carbone (CO) | Molécule | Liaison très forte, compétition avec O2 (toxicité) |
| Cytochrome c | Méthionine | Acide aminé | Liaison axiale faible (His–Fe–Met), stabilise le fer |
| Cytochrome b5 | 2ème Histidine (distale) | Acide aminé | Coordination bis-histidine (His–Fe–His) |
| Cytochrome P450 | Molécule d'O2, H2O2ou rien (transitoire) | Variable | Ligand transitoire, selon l’étape catalytique |
| Peroxydases | Molécule d'eau ou ligand transitoire | Petite molécule | Ligand transitoire, selon l’étape catalytique |
Cytochromes
Les cytochromes forment une grande famille de protéines contenant un groupe hème, impliquées surtout dans le transfert d’électrons.
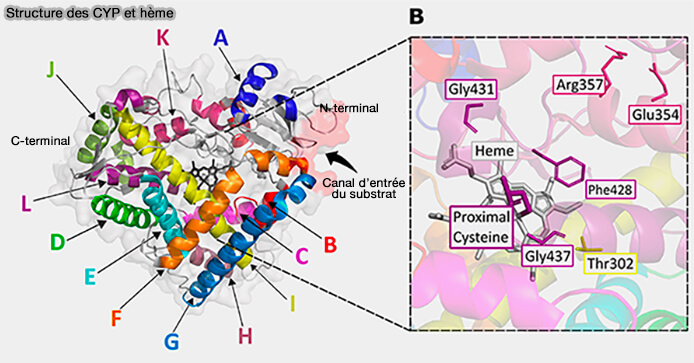
(Figure : vetopsy.fr d'après Chamboko et coll)
1. La différence chimique entre hème et cytochrome est que :
- l’hème est un cofacteur défini et isolable,
- le cytochrome est une macromolécule dont la formule dépend de sa séquence protéique et de l'hème.
Par exemple, le cytochrome 450 est composé d'environ 500 résidus et contient l'hème b.
2. La fonction des cytochromes dépend :
- du type d'hème, i.e. a, b, c… qui détermine les propriétés redox, la liaison aux gaz ou la liaison covalente au cytochrome,
- de la protéine environnante, apoenzyme qui fait varier la réactivité du fer, la sélectivité des substrats, le rôle…
Rôles des hèmes et des cytochromes
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


