Voies métaboliques
Cycle de Krebs
Oxaloacétate
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'acide oxaloacétique ($\ce{HOOCH2COOH}$) est un acide dicarboxylique, i.e. molécule comportant deux groupes carboxyliques ($\ce{R-COOH}$).
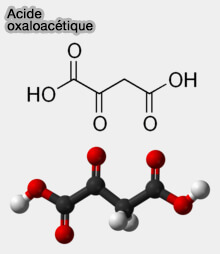
(Figure : vetopsy.fr)
L'oxaloacétate, sa base conjuguée ($\ce{HOOCH2COO-}$), est un intermédiaire essentiel dans plusieurs voies métaboliques, et en particulier dans le cycle de Krebs (
Oxaloacétate
Pour former l'ion acétate, l'acide oxaloacétique subit deux déprotonations successives et conduit alors au dianion :
$\ce{HOOC–CO–CH2–COOH}$ $\leftrightharpoons$ $\ce{^{–}OOC–CO–CH2–COOH}$, pKa = 2,22
$\ce{^{–}OOC–CO–CH2–COOH}$ $\leftrightharpoons$ $\ce{^{–}OOC–CO–CH2–COO-}$, pKa = 3,89
À pH élevé, le proton énolisable devient également ionisé, passage de l'ion oxaloacétate à l'ion énol-oxaloacétate et les formes tautomères sont stables :
$\ce{^{–}OOC–CO–CH2–COO-}$ $\leftrightharpoons$ $\ce{^{–}OOC–C(O-)–CH–COO- + H+}$, pKa = 13,03
Biosynthèse de l'oxaloacétate
à partir du malate (cycle de Krebs)

La source principale de l'oxaloacétate est sans conteste le cycle de Krebs.
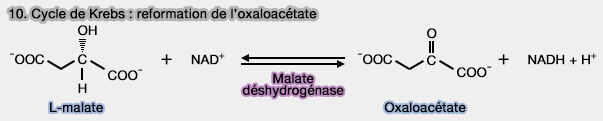
(Figure : vetopsy.fr)
1. Le L-malate est oxydé en oxaloacétate grâce à la malate déshydrogénase (EC 1.1.1.37) selon la réaction :
$\ce{L-Malate + NAD+}$ $\leftrightharpoons$ $\ce{Oxaloacétate + NADH + H+}$
2. Le L-malate peut aussi être oxydé en énol-oxaloacétate $\ce{^{–}OOC–C(O-)–CH–COO-}$ par la succinate déshydrogénase (EC 1.3.5.1) à travers une réaction de promiscuité enzymatique, l'énol-oxaloacétate étant ensuite converti en oxaloacétate par l'oxaloacétate tautomérase (EC 5.3.2.2).
à partir du pyruvate
1. La matrice mitochondriale contient la pyruvate carboxylase (PC) nécessaire pour transformer le pyruvate en oxaloacétate, carburant pour le cycle de Krebs et pour d'autres voies métaboliques (
La pyruvate carboxylase, tout comme le complexe pyruvate déshydrogénase (PDH) pour transformer le pyruvate en acétyl-CoA, se trouvent dans la matrice mitochondriale, i.e. le pyruvate doit traverser les deux membranes mitochondriales, externe (OMM) et interne (IMM) par des canaux, respectivement par les VDAC (Voltage Dependent Anion Channel) et le MPC (Mitochondrial Pyruvate Carrier).

(Figure : vetopsy.fr)
2. Le pyruvate mitochondrial est carboxylé de manière irréversible, en présence d'ATP, par la pyruvate carboxylase (PC), selon la réaction suivante :
$\ce{Pyruvate + HCO3- + ATP}$
$\longrightarrow$ $\ce{Oxaloacétate + ADP + Pi}$
3. Le pyruvate mitochondrial ne sert pas uniquement à la production d'ATP, mais fournit également le carbone à plusieurs voies biosynthétiques majeures qui transitent par le cycle de Krebs.
Structure de la pyruvate carboxylase (PC)
La pyruvate carboxylase (PC), EC 6.4.1.1, est un homotétramère, dimère de dimère, dont on retrouve une seule isoforme chez l'homme : la forme monomère n'a aucune activité enzymatique (My Favourite Enzyme Pyruvate Carboxylase 2010 et A Symmetrical Tetramer for S. aureus Pyruvate Carboxylase in Complex with Coenzyme A 2009).
L'expression de PC est massive dans tout l'organisme, en particulier dans le foie, le rein, le tissu adipeux et le coeur.
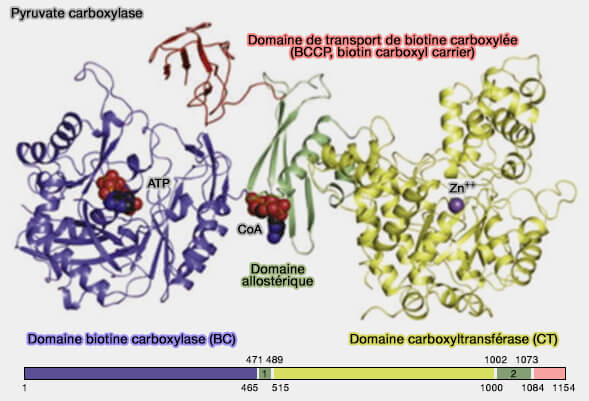
(Figure : vetopsy.fr d'après Lietzan et coll)
La PC, enzyme à domaine prosthétique constitué de biotine qui est attachée par une liaison amide ($\ce{-C(=O)N-}$) à un résidu lysine dans le domaine de transport, comprend quatre domaines (Structure, Mechanism and Regulation of Pyruvate Carboxylase 2008).
Remarque : la biotine est aussi un coenzyme de :
- l'ACC (Acétyl-CoA carboxylase alpha),
- la PCC (Propionyl-CoA carboxylase),
- la MCC (Méthylcrotonyl-CoA carboxylase).

1. Le domaine biotine carboxylase (BC), i.e. EC 6.3.4.14, qui catalyse la carboxylation de la biotine à partir du bicarbonate est classique avec ses trois domaines A, B et C (The ATP-Grasp Enzymes 2011).
- La poche de liaison de l'ATP du domaine BC est constituée d'un pli ATP-grasp, composé de deux domaines α + β qui " saisissent " une molécule d'ATP entre eux.
- Le sous-domaine B forme un couvercle à charnière qui se ferme sur l'ATP lié.
2. Le domaine carboxyltransférase (CT), qui transfère le groupe carboxyle ($\ce{-C(=O)OH}$) de la carboxy-biotine au pyruvate, pour produire l'oxaloacétate, comprend :
- un tonneau TIM α8β8 N-terminal (TIM barrel) avec un sous-domaine C-terminal qui forme un entonnoir ;
- un ion métallique (qui varie, $\ce{Zn++}$, $\ce{Mg++}$) catalytiquement essentiel à l'embouchure du canon TIM, définissant le centre du site actif pour la réaction de transcarboxylation dans ces enzymes (Transcarboxylase 5S structures: assembly and catalytic mechanism of a multienzyme complex subunit 2004).
Cet ion métallique est coordonné par le pyruvate, un acide aspartique, deux histidines et une carbamyl-lysine, i.e. la carbamylation est la fixation d’acide isocyanique ($\ce{HN=C=O}$) sur les groupements aminés des protéines, en particulier sur les résidus de lysine (
3. Le domaine protéique de transport de biotine carboxylée (BCCP, biotin carboxyl carrier) est un domaine à mécanisme dit de " bras oscillant " (swinging arm), commun dans les enzymes multifonctionnelles (Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions 2000).
-
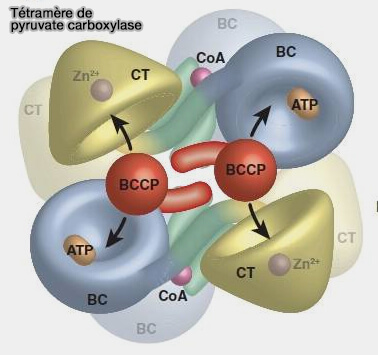
Tétramère de pyruvate carboxylase (PC)
(Figure : vetopsy.fr d'après Adina-Zada et coll) - La biotine est ainsi éloignée de la BCCP pour être positionnée à proximité du pyruvate dans le site actif CT.
4. Le domaine régulateur allostérique est constitué de deux segments séparés, formés de quatre brins β antiparallèles qui entourent une longue hélice α centrale.
- L'hélice α N-terminale lie les domaines BC et CT,
- Le segment C-terminal se replie autour de cette hélice et relie le domaine CT au domaine BCCP.
Ce domaine central, qui permet la tétramérisation de l'enzyme, i.e. qui la rend fonctionnelle en orientant les domaines individuels de PC pour la catalyse, peut fixer l'acétyl-CoA qui augmente son activité (Regulation of the structure and activity of pyruvate carboxylase by acetyl CoA 2013).
Sa liaison provoque des changements conformationnels qui servent à stabiliser la structure tétramérique de l'enzyme (Residues in the acetyl CoA binding site of pyruvate carboxylase involved in allosteric regulation
2013).- Le principal lieu d'activation de l'enzyme par l'acétyl-CoA est le domaine BC où il augmente la vitesse de réaction du clivage de l'ATP et de la carboxylation du groupe prosthétique de la biotine.
- Il améliore également la liaison de certains substrats, en particulier HCO3-, et interagit avec les ions métalliques.
Réaction catalysée par la PC
1. La réaction commence au site actif du domaine biotine carboxylase où un intermédiaire carboxy-biotine est produit à partir d'ATP, de bicarbonate et de biotine.
$\ce{E-biotine + HCO3- + ATP -> E-biotine-CO2- + ADP + Pi}$
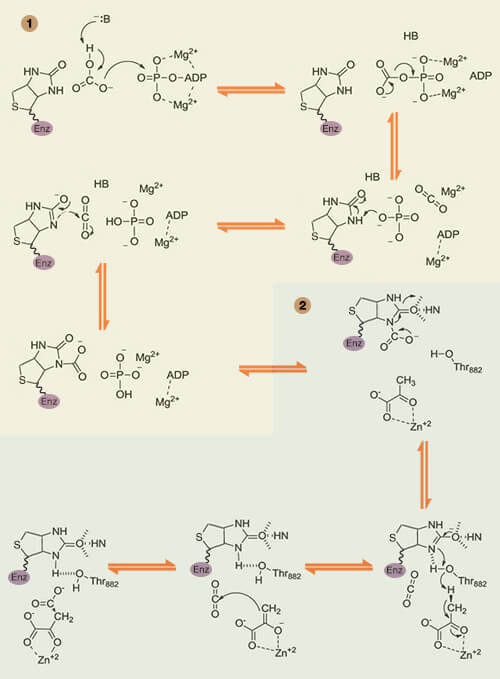
(Figure : vetopsy.fr d'après Adina-Zada et coll)
2. Le groupe carboxy-biotine est transféré au domaine carboxyltransférase voisin.
3. Là, le groupe carboxyle ($\ce{-C(=O)OH}$) est transféré de la carboxy-biotine au pyruvate, générant de l'oxaloacétate et régénérant le cofacteur de la biotine.
$\ce{Pyruvate + E-biotine-CO2- -> oxaloacétate + E-biotine}$
Régulation de la PC
Compte tenu de l'importance du PC dans le métabolisme cellulaire, son activité est finement régulée.
1. Les niveaux élevés d'acétyl-CoA augmentent son expression (Regulation of the structure and activity of pyruvate carboxylase by acetyl CoA 2012), i.e.,
- soit la demande d'énergie cellulaire est rempli et le pyruvate est utilisé pour la gluconéogenèse,
- soit l'oxaloacétate est insuffisant pour accepter l'acétyl-CoA produit par la pyruvate déshydrogénase (PDH) et le pyruvate est utilisé pour former de l'oxaloacétate afin de maintenir le flux de carbone du cycle de Krebs.

La régulation combinée de PC et du complexe pyruvate déshydrogénase (PDH) détermine donc dans quelle voie le flux de carbone global doit être engagé.
2. Vu son rôle dans la gluconéogenèse, la PC est régulée par le jeûne et l'alimentation.
- Lors du jeûne, son activité est augmentée pour faciliter la gluconéogenèse par la régulation du glucagon et des glucocorticoïdes (Calorie restriction and SIRT3 trigger global reprogramming of the mitochondrial protein acetylome 2013).
- Après les repas, son activité est diminuée pour limiter l'hyperglycémie grâce à l'action de l'insuline.
On peut trouver des déficiences en PC avec trois types A,B et C (Pyruvate carboxylase deficiency: Mechanisms, mimics and anaplerosis 2010 et Novel Mutations in the PC Gene in Patients with Type B Pyruvate Carboxylase Deficiency 2012).
à partir de l'aspartate
1. L'oxaloacétate peut être aussi formé par transamination de l'aspartate à partir de l'α-cétoglutarate, i.e. réaction anaplérotique catalysée par l'aspartate aminotransférase (ASAT ou AST), EC 2.6.1.1 :
$\ce{Aspartate + α-cétoglutarate}$ $\leftrightharpoons$ $\ce{oxaloacétate + glutamate}$
Cette enzyme se trouve en quantité importante dans le foie, les reins et le muscle cardiaque.
Leur atteinte provoque une augmentation de sa concentration sanguine et sert de marqueur biologique, comme par ailleurs l'alanine transaminase (ALT ou pyruvate transaminase glutamique ou GPT).
2. Cette enzyme intervient aussi dans la navette malate-aspartate de transfert des électrons de la NADH cytosolique, issu de la glycolyse, vers la NADH mitochondriale.
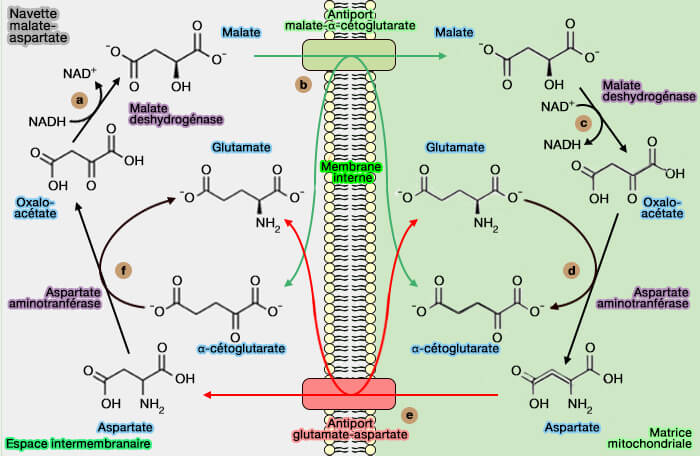
(Figure : vetopsy.fr)
Remarque : l'autre navette est la navette glycérol phosphate.
Devenir de l'oxaloacétate
1. L'oxaloacétate est un intermédiaire du cycle de Krebs, pour former du citrate avec l'acétyl-CoA sous l'action de la citrate synthase (
$\ce{Acétyl-CoA + oxaloacétate + H2O}$ $\leftrightharpoons$ $\ce{Citrate + CoA+ H+}$
2. L'oxaloacétate est un intermédiaire essentiel dans plusieurs voies métaboliques :
- la gluconéogenèse,
- la synthèse des acides aminés,
- la synthèse des acides gras,
- le cycle de Krebs et le cycle du glyoxylate (cycle analogue au premier, retrouvé chez les plantes, les bactéries et les champignons),
- le cycle de l'urée.
3. L'oxaloacétate est également un inhibiteur puissant de la succinate déshydrogénase (complexe II de la chaîne respiratoire).
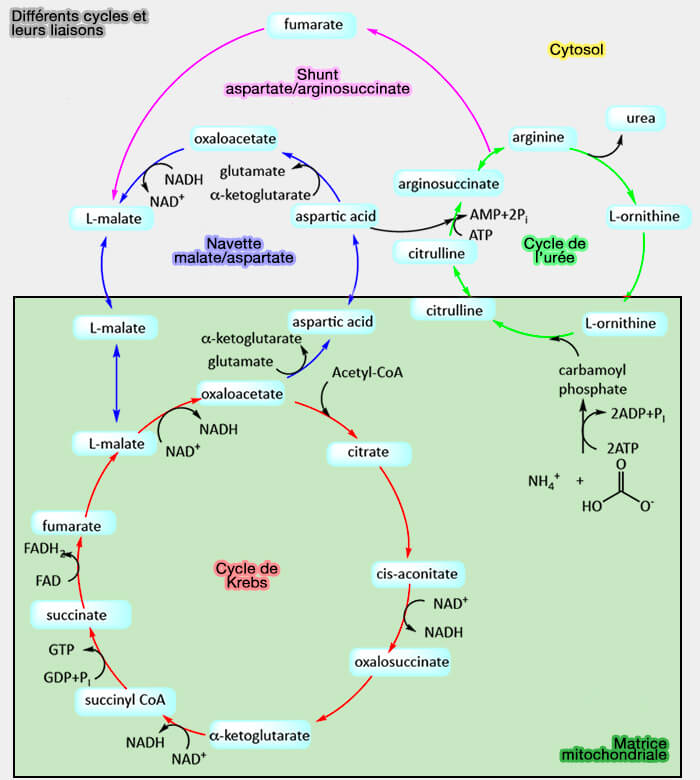
(Figure : vetopsy.fr d'après Jakubowski et Flatt)
BiochimieChimie organiqueBioénergétiqueThermodynamique et réactions chimiquesRéactions d'oxydoreduction (rédox)Composés riches en énergieATPADPAMPGTPRespiration cellulaire et production d'ATPPhosphorylation substratCycle de KrebsPhosphorylation oydativeChaîne respiratoireATP synthaseProtidesAcides nucléiquesLipidesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiques


