Transport des lipides
Transporteurs ABCG : ABCG1
Modèle et fonctions
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le transporteur ABCG1, transporteur ABC de la famille G, transporteurs à cassettes liant l'ATP (ATP Binding Cassette en anglais), est impliqué dans le remodelage des HDL (lipoprotéines de haute densité).
Les transporteurs ABCG sont principalement associés au métabolisme des lipides et des stérols.
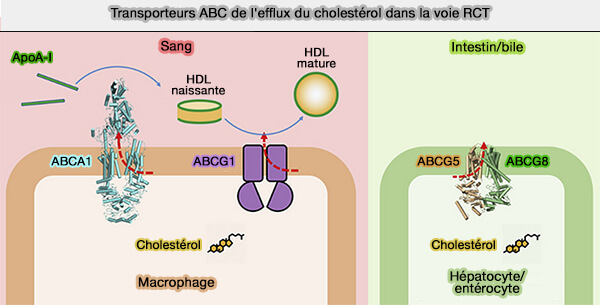
(Figure : vetopsy.fr d'après Xu et coll)

Les comparaisons entre les transporteurs ABCG1, ABCG5/8 et ABC1 sont étudiées dans : Molecular basis of cholesterol efflux via ABCG subfamily transporters (2021).
Modèle hypothétique du transport du cholestérol par ABCG1
Un modèle hypothétique de cycle de transport de ABCG1 a été proposé ((Structure and transport mechanism of the human cholesterol transporter ABCG1 2022).
1. Initialement, le dimère d'ABCG1 adopte une conformation tournée vers l'intérieur.
2. En raison de la diffusion libre dans la membrane plasmique, les molécules de sphingomyélines et de cholestérol se lient simultanément à ABCG1, ce qui entraîne la formation d'une cavité de transport hydrophobe intacte avec les hélices TM2 et TM5.
3. Lors de la liaison de l'ATP aux domaines de liaison aux nucléotides (NBD), ABCG1 adopte une condition de rotation de l'état orienté vers l'intérieur, correspondant à la structure de ABCG1 décrite dans le chapitre précédent.
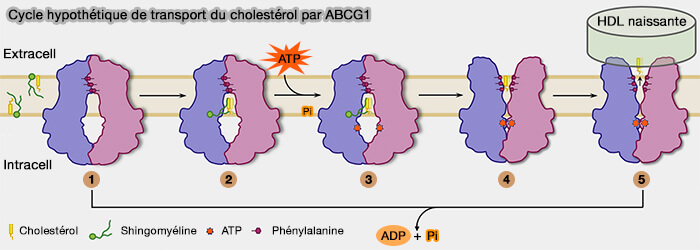
(Figure : vetopsy.fr d'après Xu et coll)
4. La structure passe par un état transitoire orienté vers l'extérieur.
La sortie riche en phénylalanine, i.e. hydrophobe, s'ouvre vers l'espace extracellulaire, retient les molécules de cholestérol en l'absence d'accepteurs extracellulaires.
5. Une fois que la préβ-HDL naissante se fixe à ABCG1 du côté extracellulaire, les molécules de cholestérol sont englouties de la sortie riche en Phe vers la HDL (lipoprotéines de haute densité), i.e. HDL étant hautement hydrophobe.
Par la suite, accompagnée de l'hydrolyse de l'ATP et de la libération de molécules de cholestérol, la sortie riche en Phe se referme et ABCG1 est réinitialisé en (1) pour recommencer le cycle.
Fonctions d'ABCG1
ABCG1 est impliqué dans le remodelage des HDL.
1. ABCG1, exprimé dans la rate, le thymus, les poumons et le cerveau et les macrophages serait localisé sur (ABCG1 Redistributes Cell Cholesterol to Domains Removable by High Density Lipoprotein but Not by Lipid-depleted Apolipoproteins 2005) :
- la membrane plasmique, ce qui permet son interaction avec les accepteurs de lipoprotéines,
- l'appareil de Golgi,
- les endosomes de recyclage.
ABCG1 pourrait transporter les stérols à travers la bicouche des endosomes avant leur fusion avec la membrane plasmique et ainsi redistribuer ces stérols vers le feuillet externe de la membrane plasmique pour faciliter leur efflux ultérieur vers les HDL ou d'autres accepteurs (ATP binding cassette transporter G1 (ABCG1) is an intracellular sterol transporter 2011).
2. Sa régulation est sous le contrôle de LXR (Liver X receptors).

L'axe miR-33/SREBP/LXR est étudiée dans des chapitres spécifiques.
Fonctions d'ABCG1 dans l'efflux de cholestérol
1. La surexpression de ABCG1 favorise l'efflux de cholestérol de différentes cellules vers les HDL (lipoprotéines de haute densité), mais pas vers l'apoA-I sans lipides (ABCG1 Redistributes Cell Cholesterol to Domains Removable by High Density Lipoprotein but Not by Lipid-depleted Apolipoproteins 2005).
- Les HDL obtenues à partir de sujets déficients en CETP (Cholesteryl ester (CE) Transfer Protein) ou de patients traités avec les inhibiteurs de la CETP ont une capacité accrue à favoriser l'efflux de cholestérol dépendant de l'ABCG1 à partir des macrophages (Cholesterol Efflux Potential and Antiinflammatory Properties of High-Density Lipoprotein After Treatment With Niacin or Anacetrapib 2010).
- L'efflux de cholestérol médié par ABCG1 vers HDL est aboli par des mutations dans le motif Walker A de liaison à l'ATP indiquant que le domaine de liaison à l'ATP dans ABCG1 est essentiel à la fois pour l'activité de transport des lipides et le trafic des protéines
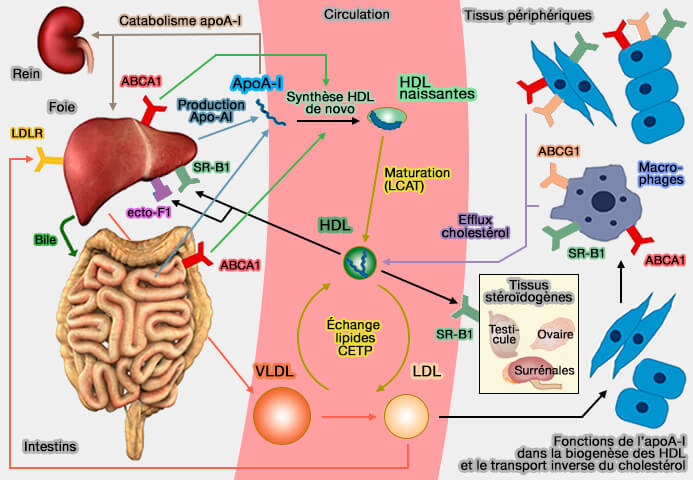
(Figure : vetopsy.fr)
2. ABCG1 favorise aussi l'efflux du 7-cétocholestérol et des oxystérols apparentés des macrophages et des cellules endothéliales vers les HDL, protégeant ainsi les cellules de l'apoptose (Inhibition of Cholesteryl Ester Transfer Protein by Torcetrapib Modestly Increases Macrophage Cholesterol Efflux to HDL 2007 et Adenosine Monophosphate Activated Protein Kinase Regulates ABCG1-Mediated Oxysterol Efflux From Endothelial Cells and Protects Against Hypercholesterolemia-Induced Endothelial Dysfunction 2010).
3. Dans les macrophages, l'excrétion du cholestérol dans le sang est d'abord initiée par ABCA1, qui transfère le cholestérol cellulaire à l'apoA-I sans lipides pour former des HDL discoïdales naissantes (préβ-HDL) dans le milieu extracellulaire (ABCA1 and ABCG1 Synergize to Mediate Cholesterol Export to ApoA-I 2005).
Par la suite, ABCG1 pompe plus de cholestérol cellulaire vers la HDL naissante, et ce processus entraîne progressivement le remodelage et la maturation des HDL, qui est finalement libérée dans le plasma (ABCA1 and ABCG1 or ABCG4 act sequentially to remove cellular cholesterol and generate cholesterol-rich HDL 2006 et Pathways by Which Reconstituted High-Density Lipoprotein Mobilizes Free Cholesterol From Whole Body and From Macrophages 2010).
4. Le rôle de l'apoA-I, le principal constituant protéique des HDL, dans le processus de transfert n'est pas clair (Effect of apoA-I Mutations in the Capacity of Reconstituted HDL to Promote ABCG1-Mediated Cholesterol Efflux 2013).
a. L'efflux de cholestérol est fortement réduit (de 89%) lors de l'utilisation de rHDL (reconstitued HDL), i.e. contenant le mutant de délétion carboxyl-terminale d'apoA-I [Δ (185–243)].
- L'efflux a été restauré à 69–99% du contrôle par les mutants de double délétion apoA-I [ Δ(1–41)Δ(185–243)] et apoA-I[Δ(1–59)Δ(185–243)].
- Ces résultats suggèrent que les hélices centrales seules de l'apoA-I associées au rHDL peuvent favoriser l'efflux de cholestérol médié par ABCG1.
b. La protéolyse de l'apoA-I associée aux HDL in vivo par les métalloprotéinases matricielles (MPP) présentes dans la paroi artérielle ou les macrophages alvéolaires produit divers fragments qui correspondent à l'apoA-I clivée après les résidus 191 ou 188 et sont compatibles en taille avec apoA-I[Δ(185-243)] (Release and Activity of Matrix Metalloproteinase-9 and Tissue Inhibitor of Metalloproteinase-1 by Alveolar Macrophages from Patients with Chronic Obstructive Pulmonary Disease 2001).
Ce processus pourrait expliquer l'accumulation de cellules spumeuses (foam cell en anglais) contenant des taux élevés de cholestérol dans les macrophages alvéolaires de souris déficientes en ABCG1 (Macrophage ABCG1 Deletion Disrupts Lipid Homeostasis in Alveolar Macrophages and Moderately Influences Atherosclerotic Lesion Development in LDL Receptor-Deficient Mice 2006).
Autres fonctions d'ABCG1
Acteur clé de l'efflux de cholestérol vers les HDL (lipoprotéines de haute densité), ABCG1 est également impliqué dans :
- la progression tumorale,
- la réponse immunitaire tumorale et a ainsi été proposé comme oncogène potentiel (Depletion of Lipid Efflux Pump ABCG1 Triggers the Intracellular Accumulation of Extracellular Vesicles and Reduces Aggregation and Tumorigenesis of Metastatic Cancer Cells 2018).
Retour aux transporteurs ABCG
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


