Transport des lipides
Transporteurs ABCG : ABCG1
Structure
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le transporteur ABCG1, transporteur ABC de la famille G, transporteurs à cassettes liant l'ATP (ATP Binding Cassette en anglais), est impliqué dans le transport des lipides.
Les transporteurs ABCG sont principalement associés au métabolisme des lipides et des stérols.
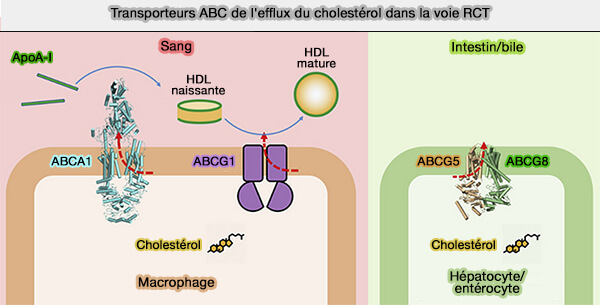
(Figure : vetopsy.fr d'après Xu et coll)

Les comparaisons entre les transporteurs ABCG1, ABCG5/8 et ABC1 sont étudiées dans : Molecular basis of cholesterol efflux via ABCG subfamily transporters (2021).
Structure d'ABCG1
Vue d'ensemble
1. ABCG1 partage une identité de séquence de 72% avec ABCG4, mais seulement 30% avec ABCG2/G5/G8 (Structure and transport mechanism of the human cholesterol transporter ABCG1 2022).
ABCG4 pourrait fonctionner comme homodimère ou hétérodimère avec ABCG1 et pourrait compléter la fonction de ABCG1, en particulier dans l'apoptose (Functional Cooperativity between ABCG4 and ABCG1 Isoforms 2016).
Sa structure générale est similaire à celle de ABCG2. Il possède par monomère (Structure of the Human Cholesterol Transporter ABCG1 2021) :
- un domaine extracellulaire (ECD),
- un domaine transmembranaire (TMD),
- un domaine de liaison aux nucléotides (NBD).

La structure détaillée des transporteurs ABC est étudiée dans un chapitre spécifique.
Structure globale
1. La structure globale du dimère d'ABCG1 adopte une conformation tournée vers l'intérieur, qui implique le repliement des deux domaines transmembranaires (TMD) sans échange de domaine, une caractéristique du transporteur ABC de type V (Structure and transport mechanism of the human cholesterol transporter ABCG1 2022).
a. Le long de l'axe double, deux TMD forment une cavité transmembranaire en forme de cône entourée par les hélices TM2 et TM5 de chaque protomère qui est ouverte vers le côté cytoplasmique et fermée du côté extracellulaire.
b. La majorité des deux domaines de liaison aux nucléotides (NBD) sont séparés l'un de l'autre, mais leurs fractions distales sont réticulées via quatre paires de ponts salins entre Lys279 d'un NBD et Glu327 et Glu322 de l'autre.
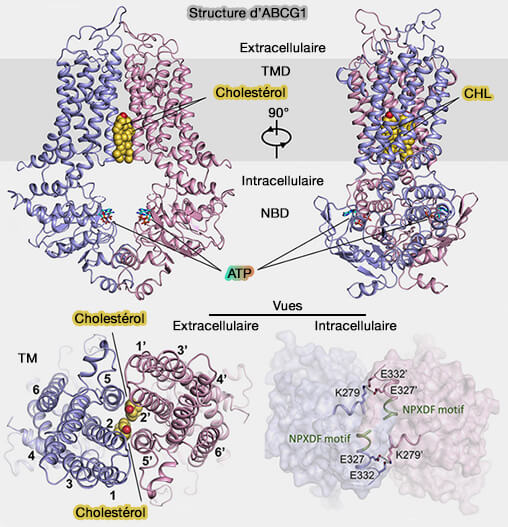
(Figure : vetopsy.fr d'après Xu et coll)
c. Les deux NBD sont également réticulés, comme dans d'autres transporteurs ABCG, par des ponts salins à partir du motif NPXDF conservé (Cryo-EM structure of ABCG5/G8 in complex with modulating antibodies 2021).
- Des mutations dans le motif NPXDF d'ABCG1 perturbent l'efflux de cholestérol (Characterization of the Role of a Highly Conserved Sequence in ATP Binding Cassette Transporter G (ABCG) Family in ABCG1 Stability, Oligomerization, and Trafficking 2013).
- Cependant, le motif NPXDF (N320PADF324) ne participerait pas à la réticulation des NBD, mais fournirait une structure hélicoïdale pour l'approche des résidus apparentés.
Sur la figure précédente, deux molécules d'ATP se lient aux motifs Walker A des NBD séparés, ce qui indique que la structure actuelle de ABCG1 doit être au stade 5 (
2. Deux molécules de cholestérol sont alignées en parallèle dans la cavité transmembranaire, à une distance d'environ 4 Å l'une de l'autre.
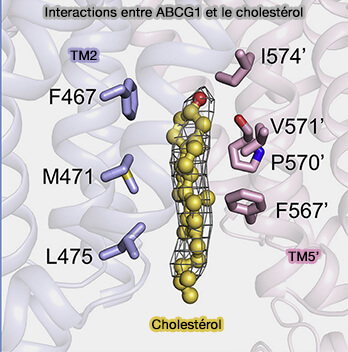
(Figure : vetopsy.fr d'après Xu et coll)
a. Chaque molécule de cholestérol forme des interactions hydrophobes étendues avec les résidus Phe467, Met471 et Leu475 de TM2 d'un protomère et avec Phe567, Pro570, Val571 et Ile574 de TM5 de l'autre protomère.
Ces résidus sont importants car l'environnement hydrophobe est crucial pour le transport du cholestérol.
b. La liaison hydrogène avec le groupe hydroxyle ($\ce{-OH}$) du cholestérol a également été observée dans d'autres modèles d'interaction cholestérol-protéine, i.e. :
- ABCB1, i.e. glycoprotéine P ou MDR1 (Structural insight into substrate and inhibitor discrimination by human P-glycoprotein 2019),
- NPC1/2 (Structural Basis of Low-pH-Dependent Lysosomal Cholesterol Egress by NPC1 and NPC2 2020),
- des récepteurs couplés à la protéine G (GPCR),
- les récepteurs de la sérotonine (Structural insights into the lipid and ligand regulation of serotonin receptors 2021).
Cette structure d'ABCG1 avec le cholestérol est très proche de celle d'ABCG2.
3. La présence de deux sphingomyélines est essentielle pour l'efflux de cholestérol médié par ABCG1.
a. Une branche est orientée parallèlement à la chaîne du cholestérol, et l'autre branche s'étend jusqu'à la membrane hors de ABCG1.
- Les cholestérols se tassent généralement contre les molécules de sphingomyéline pour maintenir l'intégrité et la fluidité de la membrane plasmique (The mystery of membrane organization: composition, regulation and physiological relevance of lipid rafts 2017).
- Le groupe acyle ($\ce{R-C(=O)-}$ de la sphingomyéline forme des interactions hydrophobes étendues avec la face α du cholestérol, ce qui suggère que la sphingomyéline devrait jouer un rôle dans le soutien de la liaison du cholestérol à ABCG1.
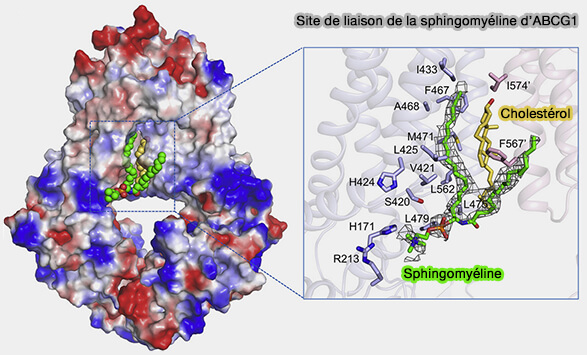
(Figure : vetopsy.fr d'après Xu et coll)
b. En outre, l'activité ATPase d'efflux du cholestérol d'ABCG1 pourraient être stimulées de manière dépendante de la sphingomyéline (ATPase activity of human ABCG1 is stimulated by cholesterol and sphingomyelin 2013).
4. Quatre paires de résidus phénylalanine, à savoir Phe459, Phe460, Phe582 et Phe583, de chaque protomère à la sortie de la cavité de transport forment de nombreuses interactions hydrophobes intra- et inter-protomères.
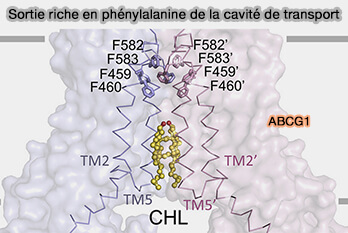
(Figure : vetopsy.fr d'après Xu et coll)
a. Les trois paires de résidus Phe (Phe460, Phe582 et Phe583) dans ABCG1 fournissent très probablement une sortie hydrophobe pour l'efflux du substrat.
Phe459 et Phe460 sont hautement conservés dans tous les membres de la sous-famille ABCG, tandis que Phe582 et Phe583 sont conservés dans les transporteurs ABCG1.
b. Les mutations de Phe460, Phe582 ou Phe583 en Ala entraînait une diminution significative de l'activité de transport, et une perte presque complète d'activité.
La mutation de Leu554 dans ABCG2 (correspondant à Phe582 de ABCG1) en Ala aurait conduit à une activité de transport accrue, elle pourrait servir de " bouchon " pendant le cycle de transport (Structure of the human multidrug transporter ABCG2 2017).
Modèle hypothétique du transport du cholestérol
par ABCG1 et fonctions
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


