Transport des lipides
Transporteurs ABCG : ABCG5/ABCG8
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les transporteurs ABCG5/8 sont des transporteurs ABC de le famille G, transporteurs à cassettes liant l'ATP (ATP Binding Cassette en anglais), sont impliqués dans le transport du cholestérol.
Les transporteurs ABCG sont principalement associés au métabolisme des lipides et des stérols.
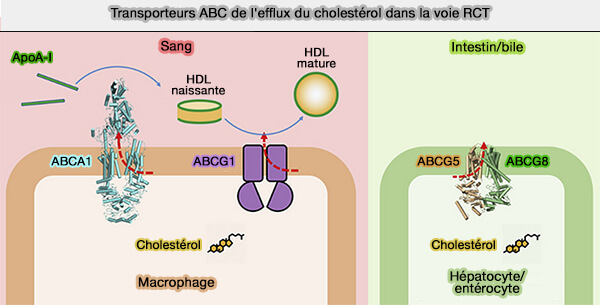
(Figure : vetopsy.fr d'après Xu et coll)

Les comparaisons entre les transporteurs ABCG1, ABCG5/8 et ABC1 sont étudiées dans : Molecular basis of cholesterol efflux via ABCG subfamily transporters (2021).
Structure d'ABCG5 et d'ABCG8
La structure générale d'ABCG5/8 comprend, par monomère :
- un domaine extracellulaire (ECD),
- un domaine transmembranaire (TMD),
- un domaine de liaison aux nucléotides (NBD).

La structure détaillée des transporteurs ABC est étudiée dans un chapitre spécifique.
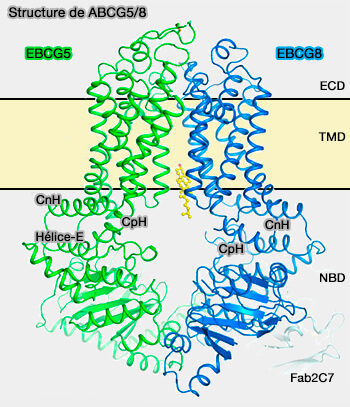
(Figure : vetopsy.fr d'après Sun et coll)
1. Chaque transporteur ABC comprend deux sites composites de liaison aux nucléotides, où le motif Walker A d'un NBD est apparié avec le motif de signature ABC de l'autre NBD (Crystal structure of the human sterol transporter ABCG5/ABCG8 2016).
- ABCG8 contient un motif Walker A dégénéré (GSSGCGRAS, RA au lieu de la séquence consensus KS ou KT).
- ABCG5 a un motif de signature ABC dégénéré (ISTGE, au lieu de LSGGQ/E).

ABCG5 est le seul capable de supporter l'hydrolyse de l'ATP, i.e. on parle d'asymétrie catalytique.
2. La structure à haute résolution révèle une interface dimère unique entre les domaines de liaison aux nucléotides (NBD)des transporteurs opposés, consistant en un réseau ordonné de ponts salins entre le motif NPXDF(XXD) conservé et servant de point pivot qui peut être important pour le cycle de transport (Cryo-EM structure of ABCG5/G8 in complex with modulating antibodies 2021).
3. Le domaine extracellulaire (ECD) est en contact intime avec le TMD compact et, malgré l'absence d'ATP, le NBD maintient un dimère étroitement fermé.
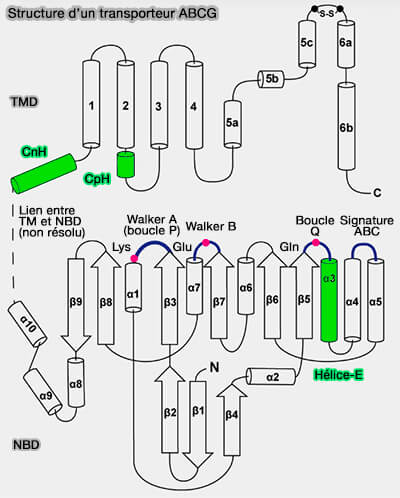
(Figure : vetopsy.fr d'après Sun et coll)
À chaque site de liaison de nucléotide, la cassette ABC et le TMD sont à proximité d'un faisceau à triple hélice qui se compose de :
- l'hélice de couplage (CpH) entre les TMH2 et TMH3 de G5 et ceux de G8 qui permettent le couplage entre les domaines NBD et TM pour l'exportation du substrat, i.e. hélice retrouvée dans las autres transporteurs ABC,
- l'hélice de connexion (CnH), hélice α orthogonale interfaciale à la bicouche membranaire qui relie aussi le NBD au TMD;
- l'hélice E est une courte hélice cytoplasmique contenant un glutamate conservé.
La boucle Q conservée des protéines ABC est également située dans cette région.
Le faisceau en triple hélice peut donc servir d'interface immédiate entre NBD et TMD.
3. le TMD contient un groupe de résidus polaires situé dans les segments transmembranaires et sur les faisceaux à triple hélice.
Ces acides aminés conservés au cours de l'évolution offrent un certain degré de flexibilité pour les TMD, préservant éventuellement des interactions polaires favorables lorsque les protéines s'engagent dans des changements de conformation au cours des cycles de transport de stérols.
4. Les ECD et les hélices transmembranaires à l'interface protéine-lipide seraient les sites hypothétiques pour la liaison et/ou l'entrée des stérols.
- La configuration de vestibule est formée par la configuration des ECD et des hélices transmembranaires et est assez grand pour accueillir des stérols plus volumineux que le cholestérol.
- A540 de ABCG5 est associé à la reconnaissance, à l'entrée et à la translocation éventuelle des stérols, i.e. sa mutation bloque l'excrétion biliaire de cholestérol.
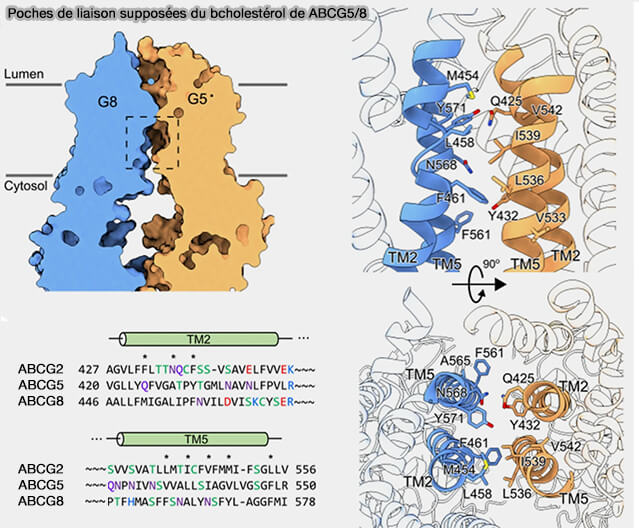
(Figure : vetopsy.fr d'après Zhang et coll)
On trouverait deux sites de liaison au cholestérol (Molecular basis of cholesterol efflux via ABCG subfamily transporters 2021).
- Le site 1 se trouve dans le feuillet cytosolique, entre les TMD de G5 et G8, parallèlement aux TMH.
- Le site 2 est enfoui dans une cavité plus hydrophobe située à mi-chemin des TMH et orientée dans un plan parallèle à la membrane.
Le cholestérol pourrait circuler du site 1 au site plus hydrophobe 2 au centre des TMH, mais le processus est obscur, i.e. on ne sait pas s'il est lié à la liaison ou à l'hydrolyse de l'ATP.
Modèle hypothétique du transport du cholestérol par ABCG5/8
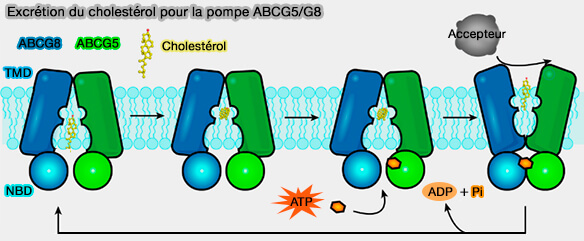
(Figure : vetopsy.fr d'après Sun et coll)
1. Un modèle propose que la cavité du feuillet cytosolique engage des stérols jusqu'à la mi-membrane (Molecular basis of cholesterol efflux via ABCG subfamily transporters 2021).
- La conformation se ferme lorsque l'ATP est engagé par NBS2 (Nucleotide-binding site 2).
- Le transporteur pousse le substrat du cholestérol vers les accepteurs de lipides extracellulaires.
- Après l'hydrolyse de l'ATP,, le transporteur revient à l'état de repos.
(Figure : vetopsy.fr d'après Jia et coll)
2. Les autres ABCG fonctionnerait à peu près de la même manière (
Rôles et régulation de ABCG5/8
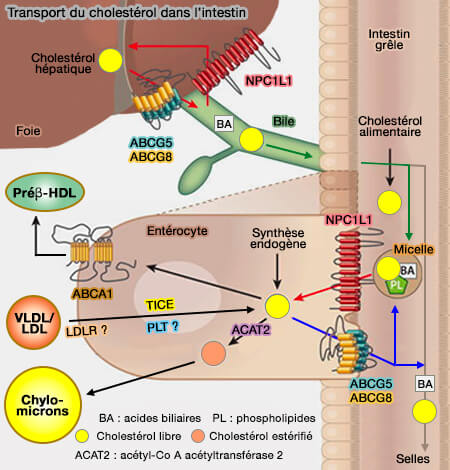
1. ABCGG5/88 transporte le cholestérol :
- des entérocytes vers la lumière intestinale (
excrétion du cholestérol libre par les entérocytes),
- des hépatocytes vers les canalicules biliaires (
excrétion du cholestérol libre par le foie).
2. ABCG5 et ABCG8, comme ABCA1 et ABCG1 sont régulés transcriptionnellement par LXR (Liver X receptors) dont l'activation améliore l'efflux de cholestérol (Cooperative transcriptional activation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 genes by nuclear receptors including Liver-X-Receptor 2013).

L'axe miR-33/SREBP/LXR est étudiée dans des chapitres spécifiques.
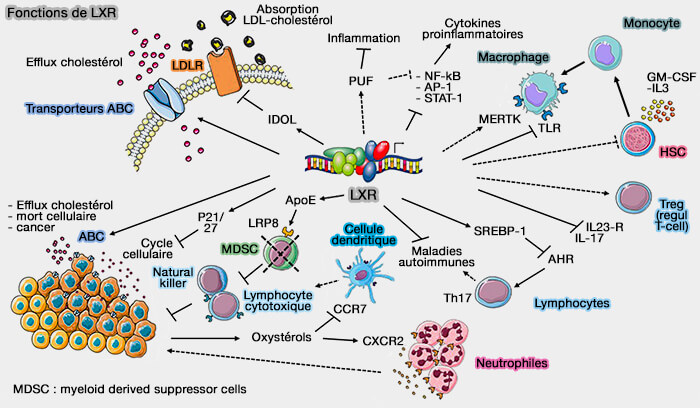
(Figure : vetopsy.fr d'après Bilotta et coll)
Retour aux transporteurs ABCG
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


