Transport des lipides
Lipoprotéines : récepteurs
Récepteurs LDLR : LRP1b
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

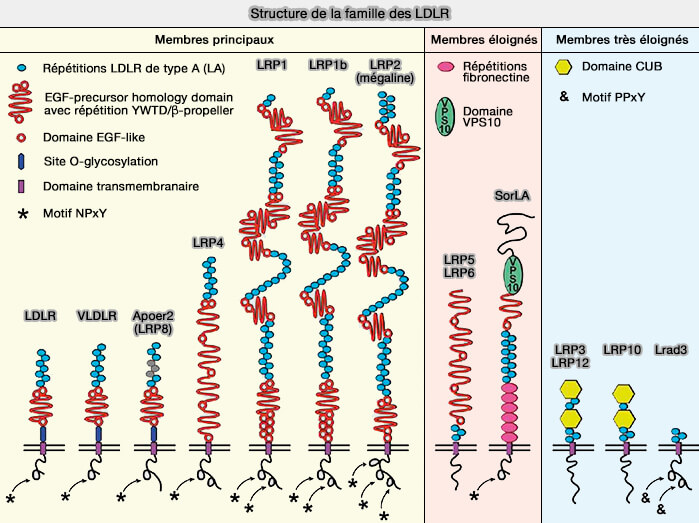
LRP1b (LDL Receptor–Related Protein-1b) est un membre de la famille des LDLR (Low-Density Lipoprotein Receptor) impliqué dans l'endocytose, i.e. il joue un rôle dans de nombreux processus cellulaires et biologiques.
(Figure : vetopsy.fr d'après Pohlkamp et coll)
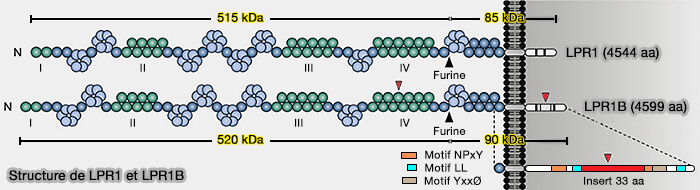
Structure de LRP1b (LDL Receptor–Related Protein-1b)
1. La structure de LRP1b (4599 résidus) est proche de celle de LRP1 (4544 résidus), i.e. 59% d'homologie, avec deux différences (LRP-DIT, a Putative Endocytic Receptor Gene, Is Frequently Inactivated in Non- Small Cell Lung Cancer Cell Lines 2000) :
- un LBR supplémentaire dans le LBD IV de l'ECD (ectodomaine),
- un insert de 33 acides aminés dans l'ICD entre les deux motifs NPxY.

La structure générale des LDLR et de LRP1 en particulier sont étudiées dans des chapitres spécifiques.
(Figure : vetopsy.fr d'après Principe et coll)
2. LRP1b est exprimé dans de nombreux tissus et fortement dans le cerveau adulte (
Comme LRP1, il se lie à de nombreux ligands, en particulier l'apoE et le fibrinogène (

Néanmoins, l'étude sur la fonction exacte et les ligands de LRP1B est entravée par la très grande taille de son gène (
- Les introns LRP1B sont 10 fois plus grands que LRP1.
- Cela affecte la possibilité de surexprimer la protéine LRP1b pleine longueur dans les cellules.
Fonctions de LRP1b
LRP1B, comme LRP1, est associé à de nombreux processus, mais en particulier, dans le cancer humain en général car c'est l'un des gènes les plus altérés par plusieurs mécanismes génétiques et épigénétiques (A Giant Lost in Cancer Translation 2021).

Quoique proche de LRP1, son endocytose beaucoup plus lente favorise la défense contre certaines pathologies.
LRP1b et cancer
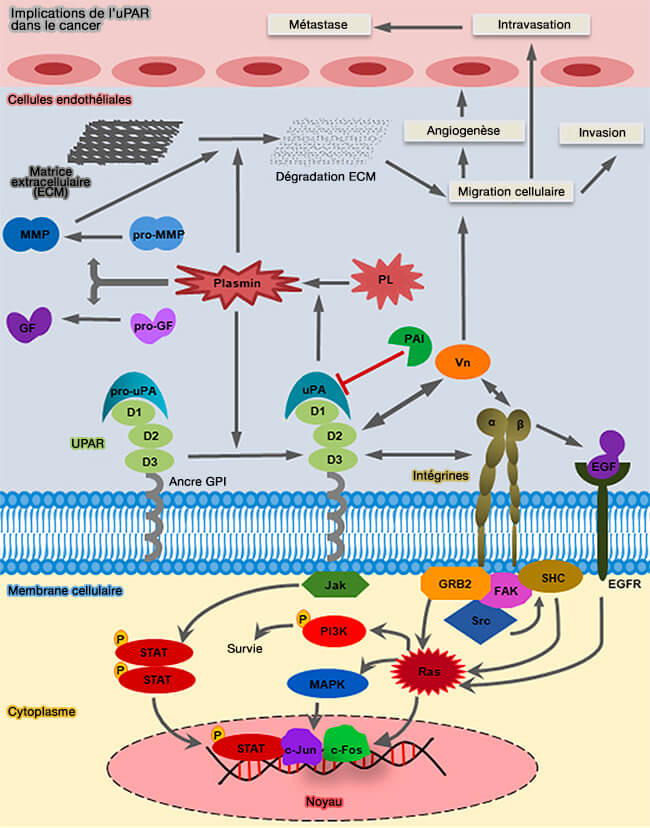
LRP1b aurait un rôle anticancéreux en limitant, entre autres, la destruction de la matrice extracellulaire par les métalloprotéinases matricielles (MPP) et donc, la migration cellulaire à l'origine des métastases.

Vous pouvez lire : Multifaceted Role of the Urokinase-Type Plasminogen Activator (uPA) and Its Receptor (uPAR): Diagnostic, Prognostic, and Therapeutic Applications (2018) et Targeting the Urokinase-Type Plasminogen Activator Receptor (uPAR) in Human Diseases With a View to Non-invasive Imaging and Therapeutic Intervention (2021).
(Figure : vetopsy.fr d'après Majmood et coll)
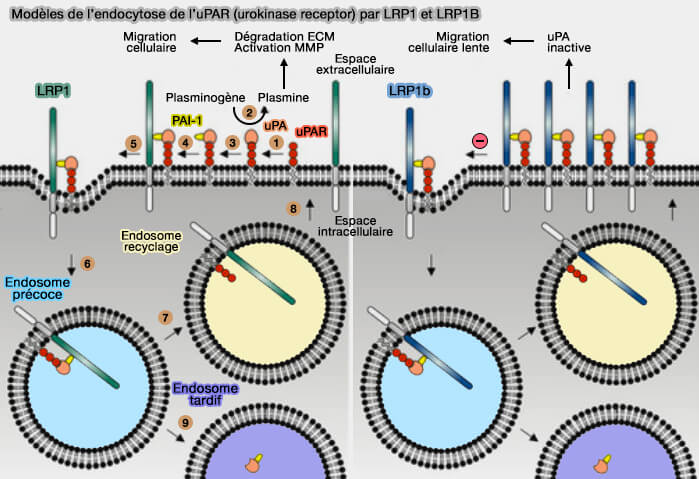
Pour bien comprendre le modèle du mécanisme, on doit faire le parallèle avec LRP1 (A Giant Lost in Cancer Translation 2021).
a. L'endocytose rapide de l'uPAR (urokinase Plasminogen Activator surface Receptor) par LRP1 s'effectue comme suit.
- 1. L'urokinase (uPA ou urokinase-type plasminogen activator), sérine protéase (EC 3.4.21.73) à trois domaines, sérine protéase, kringle et EGF-like, se lie à son récepteur uPAR, récepteur à 3 domaines LU à ancre GPI (Urokinase receptor and resistance to targeted anticancer agents 2015).
- 2. L'uPA actif, catalyse la conversion du plasminogène, i.e. son zymogène, en plasmine, qui clive et active les métalloprotéinases matricielles (MMP), i.e. la plasmine et les MMP dégradent de nombreux composants de la matrice extracellulaire (ECM) favorisant ainsi la migration tumorale et les métastases.
- 3. PAI-1 (Plasminogen Activator Inhibitor-1) se lie à l'uPA et l'inhibe en formant un complexe ternaire (uPA/PAI-1/uPAR).
- 4. La liaison de PAI-1 favorise la liaison de LRP1.
- 5. Les complexes quaternaires (uPA/PAI-1/uPAR/LRP1) sont rapidement envoyés dans les fosses recouvertes de clathrine (
endocytose clathrine-dépendante).
- 6. les complexes quaternaires sont intériorisés et délivrés dans les endosomes précoces.
- 7. LRP1 et uPAR sont triés et renvoyés dans des endosomes de recyclage.
- 8. LRP1 et uPAR sont récyclés vers la membrane plasmique.
- 9. Les complexes uPA/PAI-1 sont transportés par les endosomes tardifs vers les lysosomes pour leur dégradation.
(Figure : vetopsy.fr d'après Principe et coll)
b. L'endocytose de l'uPAR par LRP1B, beaucoup plus lente, s'effectue comme suit.
- Comme avec LRP1, LRP1B forme des complexes avec uPA/PAI-1/uPAR.
- Cependant, l'endocytose lente de LRP1B provoque une élimination lente de l'uPAR occupé de la cellule.
- En conséquence, l'uPAR occupé s'accumule sur la surface cellulaire, l'uPAR fonctionnel n'est pas régénéré efficacement, l'activité protéolytique de l'uPA est faible et la migration cellulaire est diminuée.
LRP1b et maladie d'Alzheimer
LRP1b, comme LRP1, joue un rôle dans la maladie d'Alzheimer.
1. LRP1, et non LRP1b, est susceptible de favoriser la production intracellulaire de peptides β-amyloïdes (Aβ).
2. LRP1b est à l'inverse essentiel à la clairance d'Aβ à travers la barrière hématoencéphalique (BBB, Blood–Brain Barrier) en retenant l'APP (Amyloid-beta Precursor Protein) à la surface cellulaire (The Low Density Lipoprotein Receptor-related Protein 1B Retains β-Amyloid Precursor Protein at the Cell Surface and Reduces Amyloid-β Peptide Production 2004).
3. Pour bien comprendre le modèle du mécanisme, on doit faire le parallèle avec LRP1 (A Giant Lost in Cancer Translation 2021).
a. L'endocytose rapide de LRP1 améliore l'endocytose de l'APP et, par conséquent, favorise le traitement protéolytique de l'APP par la voie amyloïdogénique (LRP1 is a master regulator of tau uptake and spread 2020 et Regulation of tau internalization, degradation, and seeding by LRP1 reveals multiple pathways for tau catabolism 2021)
- Une fois délivrée aux endosomes, l'APP est d'abord clivée par la β-sécrétase (BACE-1 ou Beta-site APP Cleaving Enzyme 1), produisant un fragment APP soluble β-clivé (sAPP-β) et un fragment β carboxy-terminal (CTF-β).
- Ce fragment est lui-même clivé par une γ-sécrétase, produisant le peptide β-amyloïde (Aβ).hautement toxique et le domaine intracellulaire d'APP (ICD-APP).
- La plupart des Aβ sont sécrétés dans l'espace extracellulaire, où ils peuvent rapidement s'agréger et former des fibrilles qui se déposent dans les plaques amyloïdes associées à la progression de la maladie d'Alzheimer.
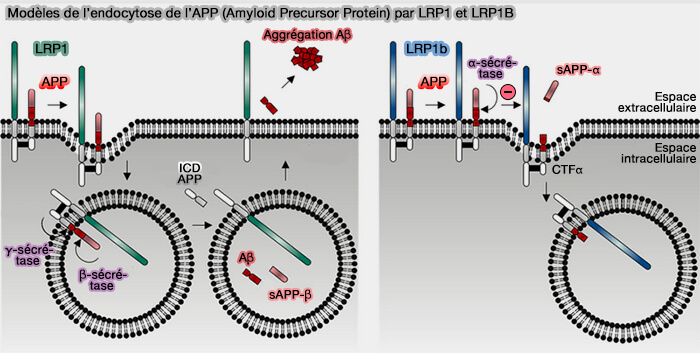
(Figure : vetopsy.fr d'après Principe et coll)
b. Par contre, l'endocytose lente de LRP1B diminue l'endocytose de l'APP et, par conséquent, favorise le traitement protéolytique de l'APP par la voie non amyloïdogène.
- A la surface cellulaire, l'APP est d'abord clivée par une α-sécrétase, produisant un fragment d'APP soluble α-clivé (sAPP-α) et un fragment α carboxy-terminal (CTF-α).
- Ce fragment peut en outre être clivé par une y-sécrétase, produisant le peptide non toxique P3 et le domaine intracellulaire APP.
Retour aux LDLR
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


