Métabolisme des lipoprotéines
LPL (LipoProtéine Lipase)
Chaperonnage et régulation
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le chaperonnage de la lipoprotéine lipases (LPL) pendant son stockage et sa synthèse ainsi que sa régulation sont complexes et n'ont été découverts que récemment.
Chaperonnage de la LPL pendant sa synthèse et sa sécrétion
La LPL est synthétisée et sécrétée sous forme de monomère et comme elle est intrinsèquement instable, elle doit être chaperonnée dans tous les compartiments pour maintenir son pli natif (GPIHBP1 and ANGPTL4 Utilize Protein Disorder to Orchestrate Order in Plasma Triglyceride Metabolism and Regulate Compartmentalization of LPL Activity 2021).
La LPL dépliée et agrégée doit être reconnue et éliminée par la dégradation associée au réticulum endoplasmique (RE) dans les protéasomes ou les autophagosomes (ULK1 prevents cardiac dysfunction in obesity through autophagy-meditated regulation of lipid metabolism 2017).
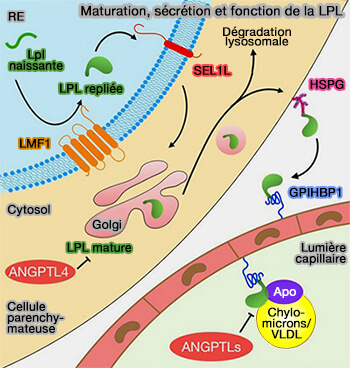
(Figure : vetopsy.fr d'après Wu et coll)
1. Au cours de la biosynthèse par les cellules parenchymateuses, la LPL est chaperonnée dans le réticulum endoplasmique (RE) par Sel1L (Sel-1 suppressor of Lin-12-like 1) et par LMF1 ou Lipase Maturation Factor 1 (Endoplasmic Reticulum Quality Control in Lipoprotein Metabolism 2019).
- Dans le déficit en Sel1L, protéine adaptatrice pour une ligase E3 dans la voie de dégradation, a LPL reste piégée dans le RE sous forme d'agrégats dépliés, qui sont éliminés par autophagie (The ER-Associated Degradation Adaptor Protein Sel1L Regulates LPL Secretion and Lipid Metabolism 2014 et SEL1L degradation intermediates stimulate cytosolic aggregation of polyglutamine-expanded protein 2021).
- Peut-être que LMF1 aide à plier les monomères LPL tandis que Sel1L garantit que seule la LPL correctement pliée sort du RE et est sécrétée par les cellules (Lipase Maturation Factor 1 (Lmf1): Structure and Role in Lipase Folding and Assembly 2010 et Lipoprotein Lipase and Its Regulators: An Unfolding Story 2022).
2. Dans la voie sécrétoire après transit depuis le réseau trans-Golgi (TGN), la LPL est chaperonnée par le SDC1 ou heparan sulfate–modified syndecan-1 (Syndecan-1 Mediates Sorting of Soluble Lipoprotein Lipase with Sphingomyelin-Rich Membrane in the Golgi Apparatus 2019).
- Dans l'espace sous-endothélial, la LPL est stabilisée par les HSPG (Heparan Sulfate ProteoGlycan) dans la matrice extracellulaire (ECM) et dans le glycocalyx des cellules parenchymateuses (ULK1 prevents cardiac dysfunction in obesity through autophagy-meditated regulation of lipid metabolismy 2017).
- Le TDM de SDC1 concentre SDC1 et LPL lié dans la membrane riche en sphingomyéline (SM), enrichissant ces cargaisons dans les vésicules lorsqu'elles bourgeonnent à partir du réseau trans-Golgi (TGN) .
3. Après la sécrétion des cellules parenchymateuses, la LPL synthétisée de novo reste attachée à leur surface par des interactions électrostatiques transitoires avec les HSPG.
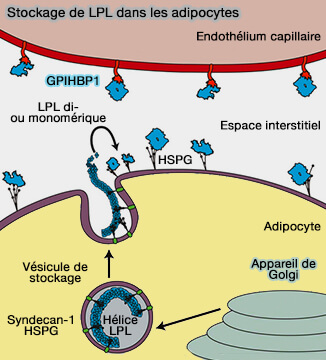
(Figure : vetopsy.fr d'après Gunn et coll)
a. Les HSPG (Heparan Sulfate ProteoGlycan) comportent de nombreuses charges négatives i.e. les héparane sulfate comportent plus de 100 résidus de glucides, qui stabilisent LPL et la protège.
C'est la clé de la forte interaction entre les HSPG et divers ligands, parmi lesquels LPL a l'une des affinités les plus élevées
- Chez les souris dépourvues de protéine de liaison aux lipoprotéines de haute densité ancrée au glycosylphosphatidylinositol (GPI), la LPL sécrétée par les adipocytes et les myocytes reste liée HSPG sur toutes les cellules des tissus (Mobility of “HSPG-bound” LPL explains how LPL is able to reach GPIHBP1 on capillaries 2017).
- Les HSPG peuvent servir de réseau de transport, aidant l'enzyme à atteindre le GPIHBP1 sur les cellules endothéliales.
b. Les HSPG ne suffisent pas à protéger la LPL de l'inactivation par les ANGPTL, suggérant que le domaine LU de GPIHBP1 est crucial pour cette fonction (GPIHBP1 stabilizes lipoprotein lipase and prevents its inhibition by angiopoietin-like 3 and angiopoietin-like 4 2009).
En outre, comme les HSPG sont présents sur les parois des capillaires, elles peuvent encore être en mesure de lier une LPL qui s'est détachée du GPIHBP1.
c. Dans le cas des macrophages et d'autres cellules, les HSPG agissent comme un pont entre la cellule et LPL, permettant à LPL de servir comme récepteur et facilitant aussi l'hydrolyse des lipides (Physiological regulation of lipoprotein lipase 2014).

Les HSPG agissent comme une plate-forme de lipolyse tout comme GPIHBP1, libérant ce dernier pour le transport d'une quantité plus importante de LPL vers le côté luminal des capillaires.
4. Les LPL des cellules parenchymateuses migrent cers les capillaires.
-
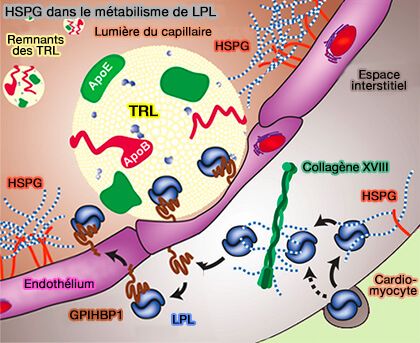
HSPG dans le métabolisme de la LPL
(Figure : vetopsy.fr d'après Gordts et coll) - La destination finale de ce mouvement dirigé de LPL est probablement le collagène XVIII, l'un des principaux HSPG déposés dans la membrane basale vasculaire (The heparan sulfate proteoglycan grip on hyperlipidemia and atherosclerosis 2018).
- À cet endroit, la LPL forme un réservoir dynamique par des interactions transitoires avec le collagène XVIII, à partir duquel elle peut être mobilisée.
GPIHBP1 par son domaine N-terminal désordonné et polyanionique sert de " leurre " qui extrait de manière transitoire la LPL du collagène XVIII.
Une interaction ultérieure avec le domaine LU plus stable de GPIHBP1 confère une longévité suffisante au complexe lui permettant de terminer l'extraction (GPIHBP1 and Lipoprotein Lipase, Partners in Plasma Triglyceride Metabolism 2019)
5. Les complexes LPL/GPIHBP1 qui se forment le long des surfaces abluminales de l'endothélium capillaire sont transcytosés dans des vésicules vers la surface luminale (GPIHBP1 Is Responsible for the Entry of Lipoprotein Lipase into Capillaries 2010).
- Ce transport endothélial croisé est bidirectionnel et indépendant de la cavéoline-1.
- Cela implique que GPIHBP1 peut transporter plusieurs molécules de LPL vers la surface luminale par des cycles répétés de transcytose.
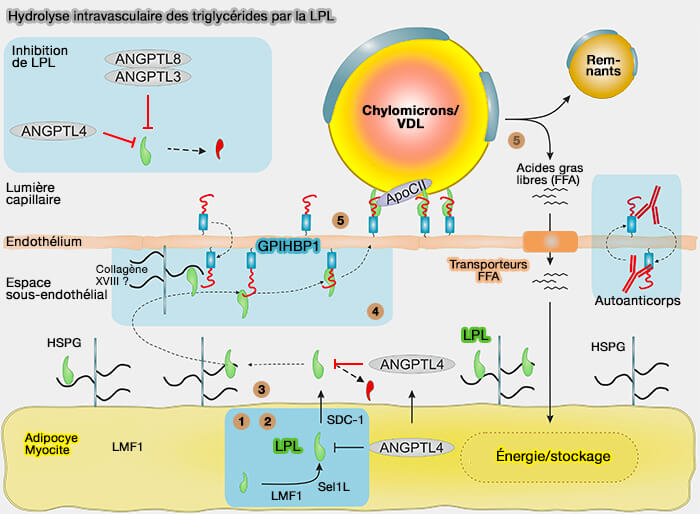
(Figure : vetopsy.fr d'après Kristensen et coll)
6. Dans la lumière capillaire, le complexe LPL-GPIHBP1 est seul responsable de la margination des TRL (lipoprotéines riches en triglycérides) circulants, principalement au niveau de structures anatomiques spéciales sur la surface capillaire qui, en microscopie électronique, apparaissent minces dans un glycocalyx plus épais (The GPIHBP1–LPL Complex Is Responsible for the Margination of Triglyceride-Rich Lipoproteins in Capillaries 2014).
6. Une fois les TRL marginés, le traitement intravasculaire de leur teneur en triglycérides est extrêmement rapide (NanoSIMS imaging: an approach for visualizing and quantifying lipids in cells and tissues 2017).
La libération d'acides gras par hydrolyse des triglycérides des TRL in vivo est cohérente avec la notion selon laquelle l'engagement de plusieurs complexes LPL/GPIHBP1 est nécessaire pour retenir les TRL sur la surface endothéliale luminale.
- La liaison efficace des TRL in vitro à la LPL-GPIHBP1 attachée à la membrane nécessite une boucle riche en tryptophane accessible dans le domaine PLAT de la LPL
- Cela pourrait expliquer la libération de remnants, particules résiduelles des chylomicrons ou des VLDL (lipoprotéines de très basse densité), dont la taille plus petite et la plus grande courbure limiteraient le nombre de complexes LPL-GPIHBP1 liés par particule, entraînant une force de liaison insuffisante pour résister à l'entrainement vasculaire (
pression de surface des TRL).
(Figure : vetopsy.fr d'après Meyers et coll)
Remarque : dans la glande mammaire, la sécrétion polarisée de LPL dans le lait par l'épithélium des canaux lactifères ne nécessite pas de GPIHBP1.
- Dans ce contexte, la LPL est produite principalement par les cellules épithéliales, mais également par les adipocytes voisins.
Elle est transcytosée dans la lumière des canaux mammaires par le récepteur lié à la sortiline (Polarized trafficking of the sorting receptor SorLA in neurons and MDCK cells 2016). - Les micelles de lipides et de caséine stabilisent probablement la LPL sécrétée dans le lait.
Régulation de la LPL
L'hypertriglycéridémie résulte de l'accumulation de TRL (lipoprotéines riches en triglycérides) dans la circulation sanguine et est associée à un risque accru de MCV (Maladies Cardio-Vasculaires).
La lipoprotéine lipase (LPL) est régulée par de nombreux facteurs que nous ne pouvons détailler tous.

La régulation de la LPL est bien expliquée dans : Lipoprotein Lipase and Its Regulators: An Unfolding Story (2020) et Regulation of Lipoprotein Lipase Activity: an In-vitro Study of a Complex and Dynamic System (2019).
Nous pouvons résumer la régulation sous forme de tableau.
| Régulateurs | Distribution tissu |
Site d'action |
Fonctions | Mécanisme |
|---|---|---|---|---|
| LMF1 | Ubiquitaire | Réticulum endoplasmique (RE) |
Acquisition des activités enzymatiques de LPL |
Chaperon pour promouvoir le pliage et la maturation appropriés de LPL |
| SEL1L | Ubiquitaire | Réticulum endoplasmique (RE) |
Sortie du RE de LPL |
Repliage correct de la LPL empêchant l'agrégation de LPL dans le RE |
| ANGPTL4 |
|
Compartiments post-RE |
Inhibition LPL (auto et paracrine) |
|
| ANGPTL3 | Foie | Lumière capillaire | Suppression de l'activité LPL de manière endocrinienne pendant l'alimentation |
Inhibition activité LPL dans un complexe avec ANGPTL 8 via une action endocrine |
| ANGPTL8 |
|
|
|
|
| GPIHBP1 |
|
Membrane plasmique de l'endothélium des capillaires |
|
Capture et stabilisation de la LPL lors de la transcytose bidirectionnelle |
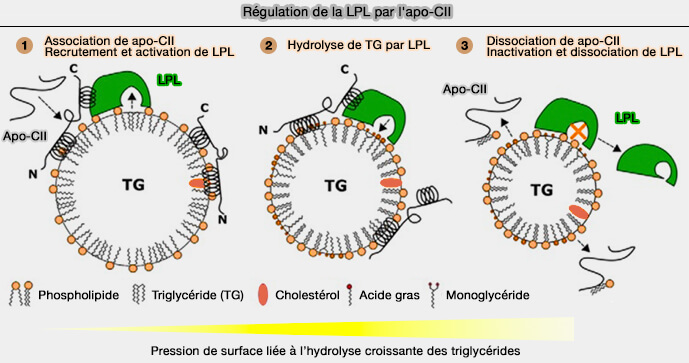
| ApoC-II | Foie | Lumière capillaire |
Cofacteur requis pour l'activité LPL dans la lumière endothéliale |
Changement de conformation LPL pour permettre l'entrée du substrat |
| ApoA-V | Foie | Lumière capillaire |
Augmentation activité LPL |
Direction des substrats de lipoprotéines vers site actif de LPL |
| ApoC-I | Foie | Lumière capillaire |
Réduction de l'hydrolyse des triglycérides par la LPL |
Obscur, déplacement des substrats ? |
| ApoC-III |
|
Lumière capillaire |
Réduction de l'hydrolyse des triglycérides par la LPL |
Obscur, déplacement des substrats ? |
| ApoE |
|
Lumière capillaire |
Réduction de l'hydrolyse des triglycérides par la LPL lors de fortes concentrations d'apoE |
Obscur |

Toutes ces molécules sont étudiées dans des chapitres spécifiques.
Retour au transport et au métabolisme des lipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


