Transport des lipides : lipoprotéines
Apolipoprotéines
ApoC-I
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine C1 (apoC-I), de la famille des apoC, joue plusieurs rôles dans les lipoprotéines.
L'apoC-I est codée par le groupe de gènes APOE/C1/C4/C2.
Structure de l'apoC-I
L'apoC-I est la plus petite des apolipoprotéines échangeables, i.e. 57 résidus.
L'apoC-I n'est pas glycolysée.
1. L'apoC-I se compose de deux hélices amphipathiques, i.e. 7-29 et 38-52 qui sont nécessaires pour l'interaction avec la surface des lipoprotéines (Changes in helical content or net charge of apolipoprotein C-I alter its affinity for lipid/water interfaces 2013).
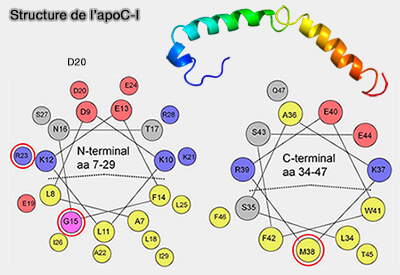
(Figure : vetopsy.fr d'après Meyers et coll)
La mutation ponctuelle dans l'un ou l'autre affecte la liaison d'apoC-I aux lipoprotéines.
2. La distribution de l'apoC-I est dépendant de l'état métabolique.
- Pendant le jeûne, l'apoC-I est principalement situés sur les HDL (lipoprotéines de haute densité).
- Pendant la phase post-prandiale, elle se déplace vers les TRL (lipoprotéines riches en triglycérides), i.e. chylomicrons (CM) et VLDL (lipoprotéines de très basse densité).
Fonctions de l'apoC-I

Les rôles d'apoC-I sont multiples et très bien décrits dans : Role of apolipoprotein C1 in lipoprotein metabolism, atherosclerosis and diabetes: a systematic review (2022).
1. L'apoC-I inhibe la lipolyse en diminuant l'activité de la LPL (LipoProtéine Lipase) comme l'apoC-III , mais plutôt en la déplaçant, plutôt qu'en inactivant l'enzyme elle-même (Apolipoproteins C-I and C-III Inhibit Lipoprotein Lipase Activity by Displacement of the Enzyme from Lipid Droplets 2013).
L'apoC-I pourrait se lier aux TRL (lipoprotéines riches en triglycérides) et augmenter la pression de surface locale au-dessus de la pression de rétention de l'apoC-II, déplaçant ainsi l'apoC-II de la surface et inhibant le catabolisme de ces lipoprotéines par la LPL (
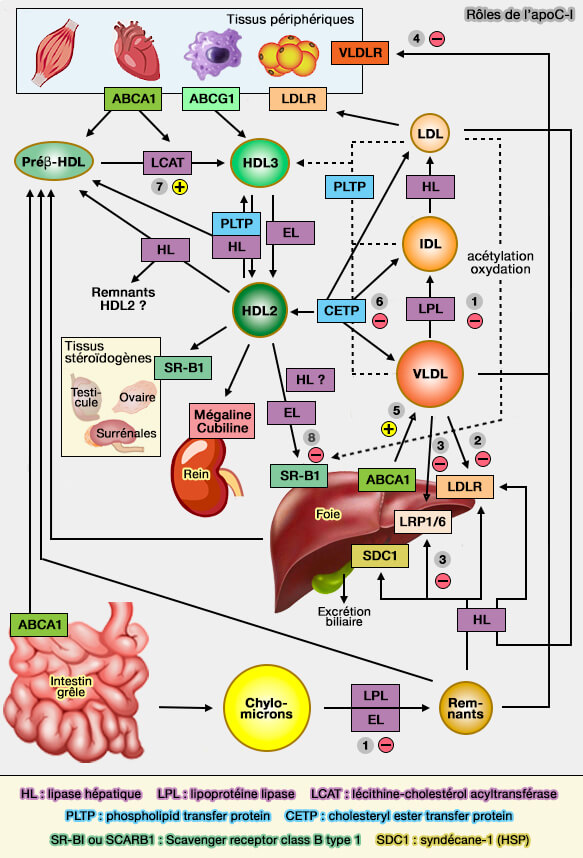
(Figure : vetopsy.fr)
3. L'apoC-I inhibe la liaison des TRL (lipoprotéines riches en triglycérides) aux différents LDLR.
L'apoC-I inhibe l'absorption hépatique des lipoprotéines via la liaison altérée soit au LDLR (Low-Density Lipoprotein Receptor), soit au LRP (LDL-Receptor Related Protein) en altérant leur interaction via l'apoE.
- Cette action inhibitrice de l'apoC-I sur la liaison des lipoprotéines au LRP était liée au déplacement de l'apoE des lipoprotéines puisque les peptides apoC-I étaient capables de déplacer des quantités importantes d'apoE des remnants de VLDL (VLDL-R ou β-VLDL) et d'inhiber la liaison des β-VLDL au LRP.
- De plus, l'apoC-I pourrait altérer la liaison médiée par l'apoE des VLDL au LDLR (, soit en masquant l'apoE, soit en modifiant la conformation de l'apoE.
4. Elle inhibe la liaison des TRL (lipoprotéines riches en triglycérides) au VLDLR (Very Low-Density Lipoprotein Receptor).
5. Elle stimule la production hépatique des VLDL (lipoprotéines de très basse densité).
6. Elle participe également au métabolisme des HDL (lipoprotéines de haute densité) en inhibant le transfert des esters de cholestérol (CE) par CETP (Cholesteryl Ester Transfer Protein).
7. Elle stimule l'activité de LCAT (Lécithine-Cholestérol AcylTransférase), qui estérifie le cholestérol libre (FC) dans le sang.
8. Elle inhibe SR-BI ou SCARB1 (SCAvenger Receptor class B type 1), récepteur des HDL (lipoprotéines de haute densité) pour la livraison du cholestérol aux cellules.
Retour aux apoC
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


