Métabolisme lipidique
LPL (LipoProtéine Lipase)
Angioprotéines-like (ANGPTL)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La famille des angioprotéines-like (ANGPTL) sont impliquées dans divers rôles, entre autres, dans le métabolisme des lipides.
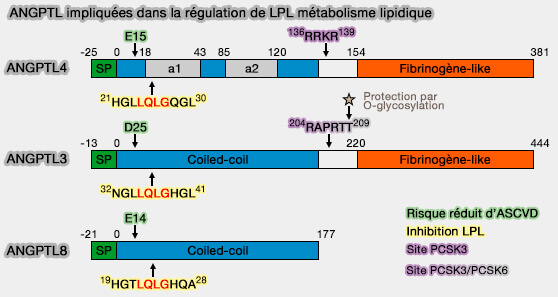
Trois angioprotéines-like (ANGPTL) principales sont impliquées dans le métabolisme lipidique par leur régulation de la lipoprotéine lipase (LPL) :
- ANGTPTL4,
- ANGTPTL3,
- ANGTPTL8.
(Figure : vetopsy.fr d'après Kristensen et coll)
Vue d'ensemble
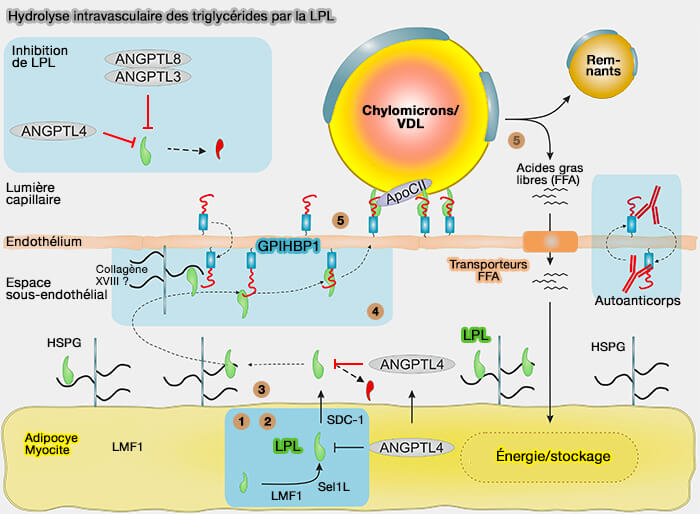
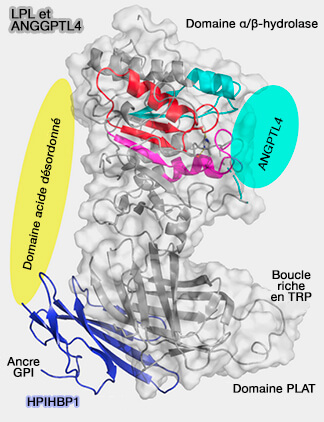
GPIHBP1 stabilise la structure de la lipoprotéine lipase (LPL) par son domaine acide, ce qui empêche le dépliement du pli α/β-hydrolase de LPL.
Ce dépliement serait provoqué par les angioproiétines-like (ANGPTL), i.e. ANGPLT3, ANGTPTL4 et ANGTPTL8, qui sont des inhibiteurs de GPIHBP1(The angiopoietin-like protein ANGPTL4 catalyzes unfolding of the hydrolase domain in lipoprotein lipase and the endothelial membrane protein GPIHBP1 counteracts this unfolding 2016).
| Protéine | Fonctions | Tissu | Récepteur |
|---|---|---|---|
| ANGPTL3 |
|
|
|
| ANGPTL4 |
|
|
|
| ANGPTL5 | Métabolisme ipidique et triglycérides |
|
LILRB2 |
| ANGPTL6 |
|
|
Récepteur ? |
| ANGPTL8 | Métabolisme ipidique |
|
Récepteur ? |
(Figure : vetopsy.fr d'après Kristensen et coll)
ANGPTL4
ANGPTL4, aussi appelé facteur adipeux induit par le jeûne, a été initialement cloné en tant que gène cible sous contrôle transcriptionnel par le récepteur activé par les proliférateurs de peroxysomes activé par les PPAR (Peroxisome Proliferator-Activated Receptor), i.e. PPAR-α et PPAR-γ.
La variation dépendante de la nutrition de l'expression d'ANGPTL4, contrairement à ANGPTL3, dans les adipocytes est régulée par le facteur de transcription de détection des acides gras libres PPARγ.
(Figure : vetopsy.fr d'après Leth et coll)
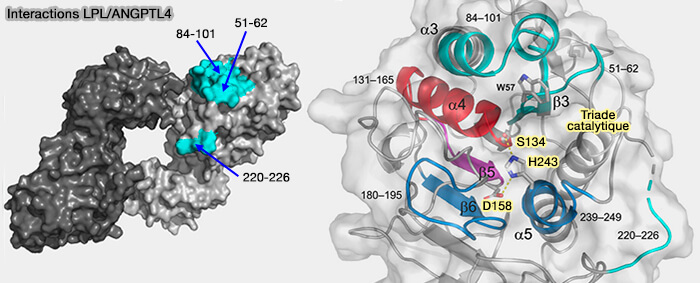
1. Selon les auteurs, ANGPTL4 humain se présenterait sous forme de monomères, de dimères et de tétramères à la surface de la cellule, formés par la réticulation covalente de liaisons disulfure intermoléculaires entre Cys51 et Cys55 du domaine coiled-coiled N-terminal (Structures of Angptl3 and Angptl4, modulators of triglyceride levels and coronary artery disease 2018).
Toutefois, on peut trouver des hétérodimères ANGPTL4/8 dans le plasma dont on ne sait si elle perturbe la formation d'homomères de ANGPTL4 (Angiopoietin-like protein 8 differentially regulates ANGPTL3 and ANGPTL4 during postprandial partitioning of fatty acids 2020).
2. La région de liaison entre les domaines N- et C-terminaux d'ANGPTL4 contient un motif de clivage de la proprotéine convertase.
Le domaine coiled-coil libéré inhibe la LPL plus efficacement que l'ANGPTL4 intact (Angiopoietin-like 4 Modifies the Interactions between Lipoprotein Lipase and Its Endothelial Cell Transporter GPIHBP1 2015).
3. L'effet inhibiteur d'ANGPTL4 dépend de manière critique d'un petit motif conservé comprenant His21, Gln25 et Gln28 dans la première hélice α du domaine enroulé (A Highly Conserved Motif within the NH2-terminal Coiled-coil Domain of Angiopoietin-like Protein 4 Confers Its Inhibitory Effects on Lipoprotein Lipase by Disrupting the Enzyme Dimerization 2009).
(Figure : vetopsy.fr d'après Kristensen et coll)
4. Le mécanisme moléculaire par lequel ANGPTL4 inhibe l'activité LPL est incomplètement compris et controversé.
- ANGPTL4 pourrait un inhibiteur non compétitif réversible de LPL (Comparison of angiopoietin-like protein 3 and 4 reveals structural and mechanistic similarities 2021).
- À l'opposé, ANGPTL4 catalyserait le déploiement irréversible du pli α/β-hydrolase de la LPL en ciblant directement les monomères LPL (The intrinsic instability of the hydrolase domain of lipoprotein lipase facilitates its inactivation by ANGPTL4-catalyzed unfolding 2021).).
- Un troisième point de vue soutient que ANGPTL4 inhibe la LPL en favorisant le clivage médié par PCSK3 de la LPL au niveau du motif de clivage séparant les domaines N- et C-terminaux (Angiopoietin-like 4 promotes the intracellular cleavage of lipoprotein lipase by PCSK3/furin in adipocytes 2018); cependant, cette régulation est probablement liée au mécanisme de déploiement de la LPL (ANGPTL4 sensitizes lipoprotein lipase to PCSK3 cleavage by catalyzing its unfolding 2021).
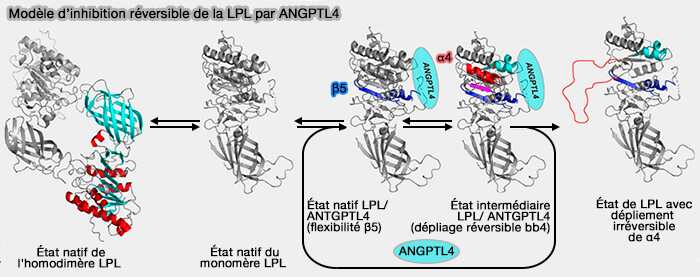
(Figure : vetopsy.fr d'après Kristensen et coll)
4. ANGPTL4 réduirait aussi la sécrétion de LPL en favorisant sa dégradation intracellulaire par clivage de PCSK3 dans les endosomes tardifs ou dans le compartiment trans-Golgien (Dijk et al., 2016, 2018).
ANGPTL3

Vous pouvez lire : Angiopoietin-like 3 in lipoprotein metabolism( 2017).
1. Les mutations du gène ANGPTL3 conduisent :
- à de faibles niveaux plasmatiques de triglycérides et cholestérol (Rare loss-of-function mutations in ANGPTL family members contribute to plasma triglyceride levels in humans 2010).
- à une hypobêtalipoprotéinémie, i.e. un faible niveau de lipoprotéines contenant des ApoB (chylomicrons, VLDL, LDL) et par une augmentation quantité d'activité LPL post-héparine
Le régulateur principal de la production d'ANGPTL3 et ANGPTL8 est le récepteur X du foie, qui régule à la hausse l'expression d'ANGPTL3/8 en réponse à l'insuline (ANGPTL8: An Important Regulator in Metabolic Disorders 2018).
2. ANGPTL3 peut être clivé in vivo par PCSK3 (intracellulaire) ou par PCSK6 (sur la surface cellulaire) au niveau de son motif de clivage de la proprotéine convertase situé dans la région de liaison.
La signification biologique de ce clivage est incertaine.
3. Un complexe oligomère d'ANGPTL3 et d'ANGPTL8 3:1 aide à réguler l'activité LPL dans les tissus oxydatifs (
Remarque : la lipase endothéliale (EL), comme LPL, est inhibé par ANGPTL3.
ANGPTL8
1. ANGPTL8, également connu sous le nom de bétatrophine, lipasine, RIFL et TD26 est lié au métabolisme des triglycérides (The ANGPTL3-4-8 model, a molecular mechanism for triglyceride trafficking 2016).
- Contrairement à ANGPTL4, l'expression d'ANGPTL8 est régulée positivement en réponse à l'apport alimentaire, i.e. fed en anglais. En effet, ANGPTL4 et ANGPTL8 sont fabriqués dans les mêmes cellules du tissu adipeux, tandis que leur production est régulée positivement par mécanismes opposés.
- La production d'ANGPTL8 est régulée à la baisse par les glucocorticoïdes en réponse au jeûne, i.e. fasting en anglais, et par la protéine kinase activée par l'AMP dans la réponse au stress.
- Dans le tissu adipeux brun, ANGPTL8 est régulé à la hausse en réponse au froid, par opposition à ANGPTL4 qui est plutôt régulé à la baisse (New insights into angiopoietin-like proteins in lipid metabolism and cardiovascular disease risk 2019).
2. Un complexe oligomère d'ANGPTL3 et d'ANGPTL8 3:1 aide à réguler l'activité LPL dans les tissus oxydatifs (NGPTL8 promotes the ability of ANGPTL3 to bind and inhibit lipoprotein lipase 2017 et On the mechanism of angiopoietin-like protein 8 for control of lipoprotein lipase activity 2019).
Cependant, la rôle des protéines individuelles dans ce complexe et le mécanisme est encore obscur (Angiopoietin-like protein 8 differentially regulates ANGPTL3 and ANGPTL4 during postprandial partitioning of fatty acids 2020).
- Soit ANGPTL8 améliore l'activité de ANGPTL3,.
- Soit ANGPTL3 est nécessaire au pliage correct de ANGPTL8, ou les deux,.
a. Normalement GPIHBP1 protège LPL des ANGPTL (The acidic domain of the endothelial membrane protein GPIHBP1 stabilizes lipoprotein lipase activity by preventing unfolding of its catalytic domain 2016). La LPL liée aux lipoprotéines est efficacement protégée des effets des protéines ANGPTL (Triacylglycerol-rich lipoproteins protect lipoprotein lipase from inactivation by ANGPTL3 and ANGPTL4 2012). Enfin, ANGPTL3 est un régulateur LPL moins puissant que ANGPTL4 (et ANGPTL8 requires ANGPTL3 to inhibit lipoprotein lipase and plasma triglyceride clearance 2017).
b. Cela laisse place à plusieurs mécanismes possibles, mais hypothétiques.
- De grandes quantités de complexes ANGPTL3/8 peuvent s'accumuler à la surface de l'endothélium et dominer les effets protecteurs de GPIHBP1 et des lipoprotéines .
- ANGPTL3 seul ou dans le complexe avec ANGPTL8 peut modifier l'interaction LPL-GPIHBP1.
- Le complexe ANGPTL3/8 peut pénétrer dans l'espace sous-endothélial, où la LPL n'est pas protégés par GPIHBP1 et les TRL.
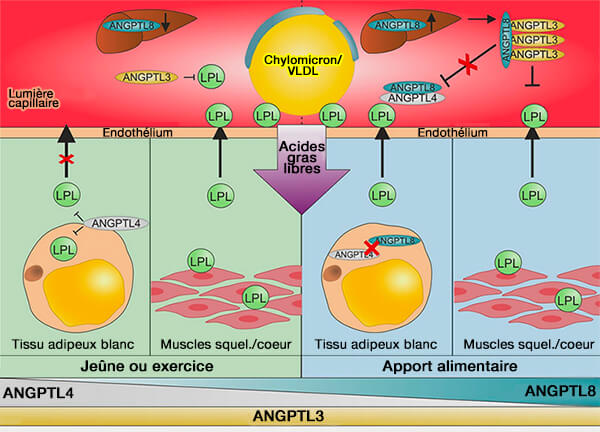
(Figure : vetopsy.fr d'après Kristensen et coll)
En construction


