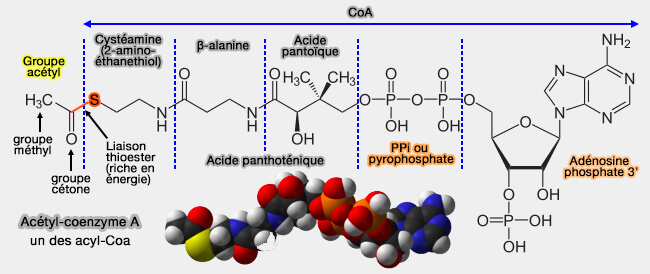
Cofacteurs
Coenzymes de transfert
Acétyl-CoA : biosynthèse à partir du pyruvate
Complexe pyruvate déshydrogénase (PDH) : vue d'ensemble et E1
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La décarboxylation oxydative du pyruvate, produit par la glycolyse, en acétyl-CoA a lieu sous l'action d'un complexe enzymatique massif hépatique, le complexe pyruvate déshydrogénase (PDH), qui comporte trois enzymes.
(Figure : vetopsy.fr)
Entrée du pyruvate dans la mitochondrie
La matrice mitochondriale contient le complexe pyruvate déshydrogénase (PDH) pour transformer le pyruvate en acétyl-CoA.
Le pyruvate doit traverser les deux membranes mitochondriales, externe et interne.
1. La membrane externe est traversée, comme la plupart des autres ions et les petites molécules, via un mécanisme de diffusion passive, i.e. qui ne consomme pas d'énergie et dont les molécules traversent selon le sens du gradient électrochimique (driving force), grâce au VDAC (Voltage Dependent Anion Channel).
2. La membrane interne mitochondriale est imperméable au pyruvate et à toutes les molécules portant une charge, ce qui permet de maintenir un gradient électrochimique (driving force) de protons nécessaire à la phosphorylation oxydative.
- Le passage nécessite donc un mécanisme de transport actif par l'intermédiaire du transporteur mitochondrial du pyruvate, i.e. MPT ou MPC, Mitochondrial Pyruvate Carrier (The Importance of Mitochondrial Pyruvate Carrier in Cancer Cell Metabolism and Tumorigenesis 2021).
- MPC fait partie de la navette citrate-malate.
Remarque : le pyruvate peut rentrer dans la cellule par les transporteurs de monocarboxylate (MCT), composés de quatre membres (MCT1-4) appartenant à la famille des gènes SLC16, qui transportent aussi le lactate (Lactate and Acidity in the Cancer Microenvironment 2020).
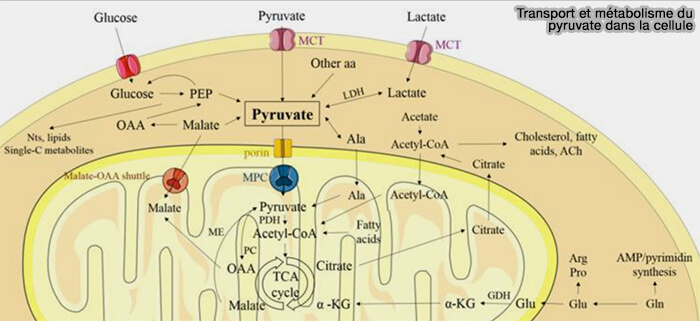
(Figure : vetopsy.fr d'après Ruiz-Iglesias et coll)
Biosynthèse de l'acétyl-CoA par décarboxylation oxydative
par le complexe pyruvate déshydrogénase (PDH)
1. La décarboxylation oxydative du pyruvate, produit par la glycolyse, en acétyl-CoA a lieu sous l'action d'un complexe enzymatique massif hépatique, le complexe pyruvate déshydrogénase (PDH), qui comporte (The Pyruvate Dehydrogenase Complexes: Structure-based Function and Regulation 2014) :
- trois enzymes (E1, E2 et E3),
- un coeur dodécaédrique pentagonal formé par E2 et E3BP, E3 binding protein (ou PDH Protein X) chez les eucaryotes, auquel les enzymes périphériques (E1 et E3) se lient étroitement mais de manière non covalente.
$\ce{Pyruvate + CoA−SH + NAD+}$ $\longrightarrow$ $\ce{Acetyl−CoA + CO2 + NADH +H+}$
a. Le complexe PDH humain est une méga-enzyme multienzymatique, i.e. 10 MDa, jusqu'à ~100 protéines et plus dans le complexe, i.e. les nombres peuvent varier selon les auteurs et les espèces, organisée autour :
- d’un noyau central composé d'environ 30 sous-unités E2 qui forment 10 trimères et d'environ 12 E3BP souvent tétramériques,
- 30 E1 formant 15 dimères,
- 6 E3 formant 3 dimères.
b. Les complexes enzymatiques sont avantageux par rapport aux enzymes isolées car :
- les distances entre les différents substrats et les sites actifs sont réduites,
- les intermédiaires métaboliques ne risquent pas de subir des réactions parasites,
- une régulation des réactions est possible.

Vous pouvez lire : Dynamics of the mammalian pyruvate dehydrogenase complex revealed by in-situ structural analysis (2025) et Molecular architecture of mammalian pyruvate dehydrogenase complex (2024) et Mitochondrial Alpha-Keto Acid Dehydrogenase Complexes: Recent Developments on Structure and Function in Health and Disease (2024).
2. La réaction irréversible ($\Delta G_0'$= -33,5 kJ/mol) suivante nécessite l'intervention de cinq cofacteurs :
$\ce{Pyruvate + CoA-SH + NAD+}$ $\longrightarrow$ $\ce{Acétyl-CoA + NADH + H+ + CO2}$
| Enzyme | Abrev. | Cofacteurs |
|---|---|---|
| Pyruvate déshydrogénase (PDH) (EC 1.2.4.1 : décarboxylase) |
E1 | Thiamine pyrophosphate (TPP) |
| Dihydrolipoyl/dihyrolipoamid S-acétylltransférase (DLAT) (EC 2.3.1.12 : acyltransférase) |
E2 |
|
| Dihydrolipoyl/dihyrolipoamide déshydrogénase (DLD) (EC 1.8.1.4 : oxydo-réductase) |
E3 |
Une molécule de glucose produit deux pyruvates et 2 NADH qui généreront par la phosphorylation oxydative six ATP, i.e. trois fois deux (
Pyruvate déshydrogénase (PDH ou E1)
Structure de E1
1. La pyruvate déshydrogénase (E1), EC 1.2.4.1, est une décarboxylase à complexe hétérotétramérique contenant deux dimères E1α/E1β.
20-30 complexes E1 s'associent au complexe de noyau E2/E3BP par des interactions entre E1 et E2 (Interaction of E1 and E3 components with the core proteins of the human pyruvate dehydrogenase complex 2009).
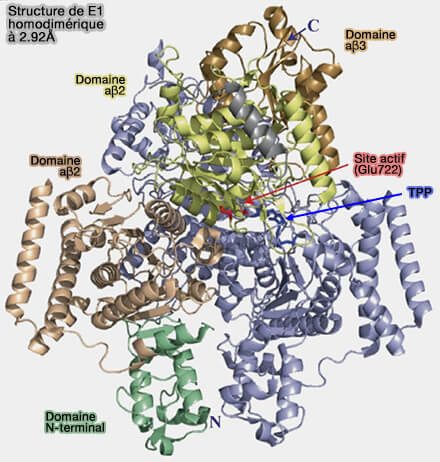
(Figure : vetopsy.fr d'après Szabo et coll)
1. La sous-unité α est constituée par :
- α1 (PDHA1), ubiquitaire, codé par le chromosome X,
- α2 (PDHA2), spécifique aux cellules germinales mâles, codé par le chromosome 4
2. La sous-unité β, ubiquitaire, est codée par le chromosome 3.
Remarque : dans la figure ci-contre, on note une sous-unité αβ3, car le complexe PDH est un assemblage multisous-unités, souvent avec plusieurs copies identiques ou presque identiques de la paire αβ.
Mécanisme
1. Le site actif de E1 est situé dans une fente profonde formée à l'interface entre les sous-unités α et β et contient un cofacteur thiamine pyrophosphate (TPP) et un ion magnésium $\ce{Mg++}$ qui permet le couplage de :
- la décarboxylation oxydante du pyruvate (acide α-cétonique) est considérée comme une décarboxylase, i.e. élimine un groupe carboxyle ($\ce{-C(=O)OH}$) des composés organiques,
- l'acylation réductrice subséquente du fragment lipoyle du lipoamide, cofacteur catalytique qui est lié de manière covalente à la dihydrolipoyl S-acétyltransférase (E2).
$\ce{CH3-CO-COO- + TPP$ $\longrightarrow$ $\ce{CH3-CH(OH)-TPP (HETPP) + CO2}$
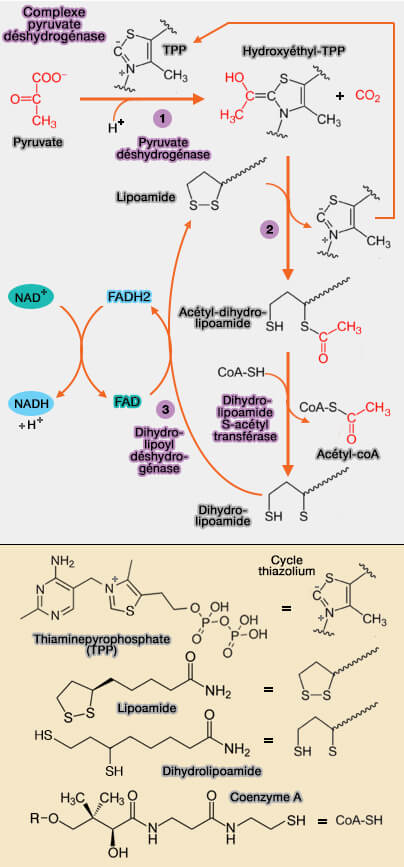
(Figure : vetopsy.fr)
2. Le groupe hydroxyéthyle $\ce{CH3-CHOH)-} formé par la décarboxylation du pyruvate est immédiatement lié au TPP, sous la forme d'hydroxyéthyl-TPP (HETPP), ce qui correspond à une activation du groupe acétyle ($\ce{-C(=O)-CH3}$).
- L'énergie dégagée au cours de la décarboxylation (passage de E' = - 0,60 V à E' = - 0,40 V) permet la formation d'une liaison " riche en énergie ", thioester ($\ce{R–S–CO–R'$}).
- Le cycle thiazolium du TPP est sous forme zwitterionique, i.e. forme ylide ou ylure en français, et le carbone anionique C2 effectue une attaque nucléophile sur le C2 du pyruvate afin de le fixer.

Cette réaction est étudiée dans le mécanisme d'action de la TPP.
3. L'HETPP est transféré après oxydation de la sous-unité E1 sur le lipoamide lié à la dihydrolipoyl transacétylase (E2), acylation réductrice.
$\ce{CH3-CH(OH)-TPP + lipoamide$ $\longrightarrow$ $\ce{CH3-CHO)-S-dihydrolipoamide +TPP}$
- Le groupe hydroxyéthyle est oxydé en groupe acétyle, i.e. passage d’un alcool secondaire à une cétone.
- Le groupe acétyle est transféré sur le groupe thiol ou sulfhydryle ($\ce{R−SH}$) du lipoamide lié à E2.
- Ce transfert conduit à la formation de l’acétyl-dihydrolipoamide, c’est-à-dire une forme réduite du lipoamide portant le groupe acétyle, i.e. les deux atomes de soufre initialement liés en pont disulfure sont maintenant sous forme –SH, un des groupes thiol portant l'acétate.
- Le TPP est libéré et régénéré pour un nouveau cycle.
Dihydrolipoyl/dihydrolipoamide S-acétyltransférase (DLAT ou E2)
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCofacteursCofacteurs d'oxydoréductionCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


