Enzymes :
Groupe des hydrolases (EC 3)
Protéases (peptidases ou enzymes protéolytiques)
Modes d'action
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation
Les peptidases (protéases ou enzymes protéolytiques), classées parmi les hydrolases, assurent, en grande partie, la dégradation des protéines (protéolyse).
Les autres processus peuvent être la digestion intramoléculaire, ainsi que la protéolyse par des températures élevées ou par des pH bas.

La base de données MEROPS est une ressource d'information inépuisable sur les peptidases et les protéines qui les inhibent.
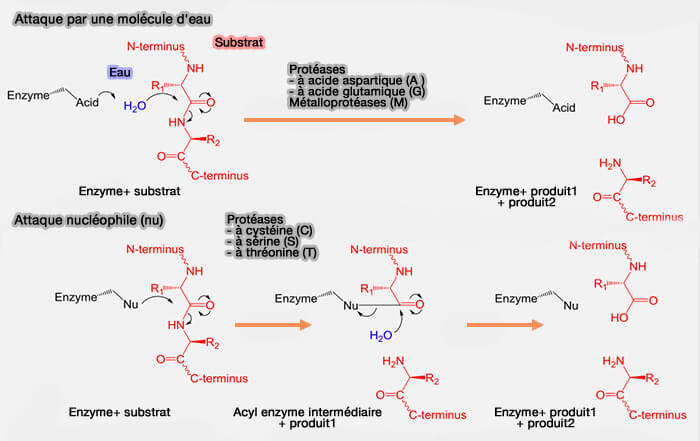
(Figure : vetopsy.fr d'après Wu)
Nucléophile-électrophile
Le clivage d'une liaison peptidique s'effectue en plusieurs temps pour créer une attaque nucléophile du groupe carboxyle ($\ce{R-C(O)OH}$) du peptide (
1. Un nucléophile, qui aime les noyaux, donc les charges positives, est un composé chimique attiré par les espèces chargées positivement : il donne une paire d'électrons à des composés électrophiles pour former une liaison chimique.
Un nucléophile est une espèce chimique qui :
- possède un doublet d’électrons libres, pour former des liaisons,
- est attirée par les zones chargées positivement ou pauvres en électrons, i.e. substrat électrophile,
- peut être chargé négativement, i.e. OH-, Cl-…
- peut être neutre avec des doublets libres, i.e. H2O, NH3, mais aussi des acides aminés par leur groupe alcool ($\ce{-OH}$), imidazole ou thiol…
| Acide aminé | Groupe fonctionnel | Caractère nucléophile |
|---|---|---|
| Sérine (Ser, S) | Alcool ($\ce{-OH}$) |
Bon nucléophile |
| Thréonine (Thr, T) | Alcool ($\ce{-OH}$) |
Bon nucléophile |
| Tyrosine (Tyr, Y) | Phénol ($\ce{-C6H5-OH}$) |
Modérément nucléophile |
| Cystéine (Cys, C) | Thiol ($\ce{-SH}$) |
Très bon nucléophile |
| Lysine (Lys, K) | Amine ($\ce{-NH2}$) |
Bon nucléophile (surtout à pH basique) |
| Histidine (His, H) | Imidazole (N) |
Noyau azoté nucléophile (souvent catalytique) |
| Arginine (Arg, R) | Guanidine | Faiblement nucléophile |
| Aspartate (Asp, D) | Carboxyle ($\ce{-C(=O)OH}$ |
Peut agir comme nucléophile (surtout en catalyse acido-basique) |
| Glutamate (Glu, E) | Carboxyle ($\ce{-C(=O)OH}$ |
Peut agir comme nucléophile (surtout en catalyse acido-basique) |
2. Un électrophile est un composé chimique déficient en électrons : il possède une charge élémentaire positive ($\ce{e+}$) ou une charge partielle ($\ce{δ+}$). Il attaque les aires riches en électrons comme les liens $\ce{C=C}$.
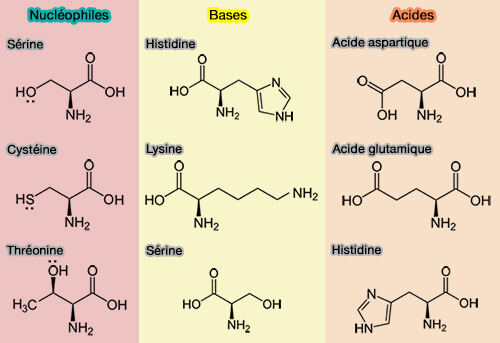
(Figure : vetopsy.fr)
Remarque : un radical libre possède un électron libre qu'il veut apparier à un autre et est donc très réactif chimiquement avec d'autres composés.
C'est la troisième forme d'attaque classique, mais qui n'intervient pas dans les protéases.
Attaque par un résidu nucléophile
Une attaque nucléophile est le processus par lequel une espèce chimique appelée nucléophile, i.e. riche en électrons, " attaque " un atome pauvre en électrons, souvent un carbone électrophile, pour former une nouvelle liaison chimique.
$\ce{Nucléophile- + R-L}$ $\longrightarrow$ $\ce{R−Nucléophile + L-}$ où $\ce{L}$ est le groupe partant, i.e. leaving group en anglais
Vue d'ensemble
Cette attaque nucléophile peut être effectuée par un résidu d'acide aminé comme la cystéine (C), la sérine (S) ou la thréonine (T).
1. En règle générale, c'est une triade catalytique (nucléophile, base et acide) qui officie, i.e. ensemble de trois acides aminés coordonnés qui sont trouvés dans le site actif de certaines enzymes (Intrinsic evolutionary constraints on protease structure, enzyme acylation, and the identity of the catalytic triad 2013).
On les trouve dans les hydrolases, i.e. protéases, les amidases, les estérases, les acylases, les lipases, les β-lactamases et les - transférases.
a. Le plus souvent, un résidu d'histidine est utilisé pour activer la sérine, la cystéine ou la thréonine, utilisées comme nucléophiles.
b. En effet, les 20 acides aminés ne contiennent pas de groupes fonctionnels suffisamment nucléophiles pour réaliser la catalyse tout seuls.
- Les groupes nucléophiles sont formés par le groupe hydroxyle ($\ce{-OH}$) de la sérine, le groupe thiol/ion thiolate ($\ce{SH/S−}$) de la cystéine.
- La thréonine utilise son deuxième groupe hydroxyle, et se sert de l'amide N-terminale de la protéase comme base (Unconventional serine proteases: Variations on the catalytic Ser/His/Asp triad configuration 2008).

Les triades les plus classiques sont Ser-His-Asp, Cys-His-Asp.
2. Ce mécanisme est retrouvé dans au moins 23 superfamilles distinctes et est l'un des mieux étudiés en biochimie.
Déprotonation du résidu nucléophile
Vue d'ensemble
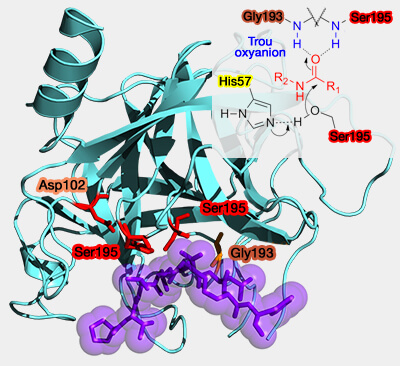
(Figure : vetopsy.fr d'après Yikrazul et Richardliu12)
Le résidu nucléophile est polarisé et déprotoné par la base (en général l'histidine, mais aussi quelquefois, la lysine ou le groupe amide dans les protéases à thréonine) qui accroît ainsi son activité (
- La base est stabilisée par une liaison hydrogène par l'acide qui est, dans les conditions normales de pH, l'acide aspartique (aspartate) et l'acide glutamique (glutamate).
- Cette liaison oriente correctement la base pour inhiber la rotation de toute la chaîne et la placer dans une position adéquate à la polarisation du résidu nucléophile.
Ce résidu n'est pas indispensable dans certaines protéases car l'histidine peut être orientée d'une autre manière, par exemple par l'asparagine dans la papaïne, ou une molécule d'eau pour certaines protéases de virus (hépatite A).
Mécanisme classique
Le mécanisme est le suivant.
1. Le nucléophile force l'oxygène du groupe carbonyle ($\ce{C=O}$) à accepter un électron, conduisant à un premier intermédiaire tétraédrique.
2. Un intermédiaire acyl catalytique (ou intermédiaire acyl-enzyme) est formé dans lequel le groupe carboxyle ($\ce{-C(=O)OH}$) est lié de manière covalente au nucléophile catalytique après le clivage du reste du substrat protoné par la base.
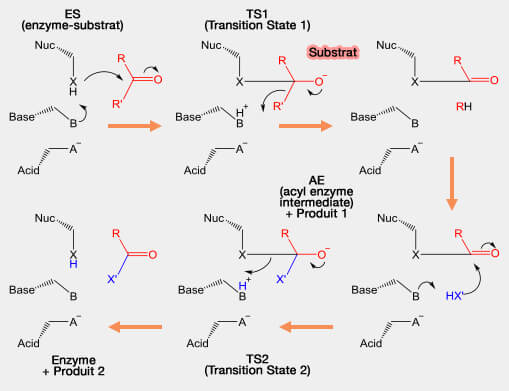
(Figure : vetopsy.fr d'après Thomas Shafee)
Cet intermédiaire est stabilisé par des résidus donneurs d'hydrogène, qui forment un trou oxyanion.
- Un trou oxyanion est une cavité dans la structure d'une enzyme qui stabilise un atome d'oxygène ou un alcoolate (alkoxide) déprotoné, souvent en le plaçant à proximité d'un résidu chargé positivement.
- Cette poche est le plus souvent formée d'amides ou de résidus chargés positivement.
3. Puis, cet intermédiaire acyl catalytique est attaqué par un autre substrat pour former un second intermédiaire tétraédrique qui éjectera le nucléophile pour régénérer la protéase et libérer le produit. Ce second substrat peut être :
- une molécule d'eau qui hydrolyse le produit,
- une molécule organique qui se transfère au produit : la protéase agit alors comme une transférase, dans ce cas une acyltransférase.
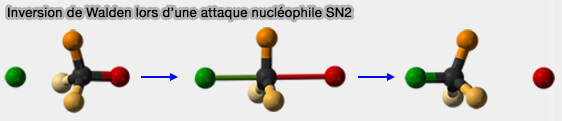
Réaction de substitution nucléophile bimoléculaire (SN2)
Le terme SN2 signifie substitution nucléophile bimoléculaire qui dépend de 2 espèces dans l'étape déterminante.

La liaison se forme en même temps que l’autre se rompt, i.e. il n'y a donc pas d'intermédiaire.
1. C'est le cas par exemple :
- des méthyltransférases,
$\ce{Nu- + CH3−SAM}$ $\longrightarrow$ $\ce{Nu-CH3 + S-adénosylhomocystéine}$
- des glycosyltransférases,
- des ADN méthylases…
(Figure : vetopsy.fr)
2. Dans ce cas, il y a une inversion de configuration au niveau du carbone attaqué.
- L'inversion de Walden fait référence au changement de chiralité du carbone attaqué.
- Cela signifie qu’un carbone chiral change de configuration de R à S ou de S à R au cours de la réaction.
Attaque par une molécule d'eau
Vue d'ensemble
L'attaque nucléophile peut être effectuée par une molécule d'eau activée (protéases A, M, G) pour former un ion hydroxyde ($\ce{OH-}$) qui est alors capable d'attaquer la liaison isopeptidique.
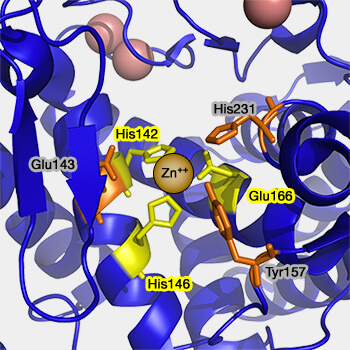
Dans le cas des métalloprotéases, c'est un cation divalent, en général $\ce{Zn++}$, qui active $\ce{H2O}$.
- L'ion métallique est maintenu en bonne place par des résidus d'acides aminés, en général 3, dont les plus fréquents sont l'histidine, le glutamate, l'aspartate ou la lysine.
- Le motif HExxH est commun à la moitié des métalloprotéases (A theoretical study of the mechanism for peptide hydrolysis by thermolysin 2002).
(Figure : vetopsy.fr)
Mécanisme
Le mécanisme est un peu différent pour les métalloendoprotéases et les métalloexoprotéases (
1. Pour la thermolysine (métalloendoprotéase bacillaire) ou les métalloprotéinases matricielles (MPP), un quatrième résidu (en plus du motif HExxH - His142, Glu143, His 146 -), Glu166 est requis pour la catalyse et jouerait le rôle d'électrophile (Matrix metalloproteinases: Fold and function of their catalytic domains 2010).
- La liaison tétraédrique de $\ce{Zn++}$ est complétée par une molécule d'eau nucléophile (W pour water ou $\ce{H2O}$).
- Le substrat déplace les hydrogènes de $\ce{H2O}$) vers Glu143, tandis que l'oxygène de $\ce{H2O}$) reste associé à $\ce{Zn++}$ : le complexe enzyme-substrat (ES) est formé par $\ce{Zn++}$ associé à l'oxygène de l'extrémité du substrat.
Glu143 polarise $\ce{Zn++}$ et permet l'attaque nucléophile du groupe carbonyle du substrat par l'O de $\ce{H2O}$) associé à $\ce{Zn++}$ (cf. voie acide/base sur la figure ci-dessous).
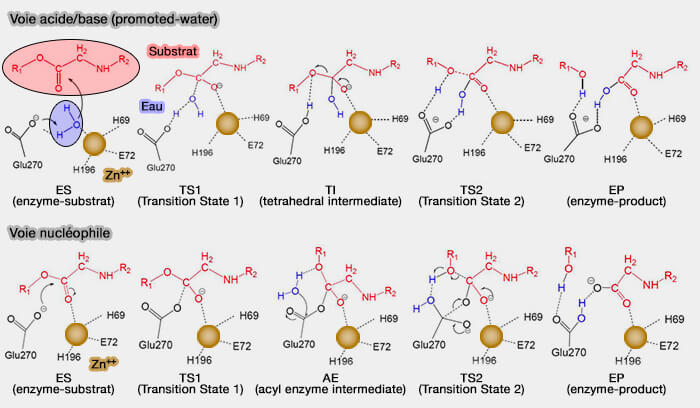
2. Pour la carboxypeptidase A, une métalloexopeptidase, deux voies coexistent (Catalysis of Carboxypeptidase A: Promoted-water vs Nucleophilic Pathways 2010) :
- la voie acide/base (promoted-water),
- la voie nucléophile (ou anhydride).
(Figure : vetopsy.fr d'après Wu)


