Transport des lipides : lipoprotéines
Apolipoprotéines
ApoA-II
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'apolipoprotéine A2 (apoA-2), de la famille des apoA, majoritairement exprimé dans le foie, deuxième apolipoprotéine la plus abondante après l'apoA-I, représente environ 20 % des apolipoprotéines présentes dans les HDL (lipoprotéines de haute densité).
Vue d'ensemble de l'apoA-II
1. En raison d'une plus grande affinité pour les lipides par rapport à l'apoA-I, l'apoA-II semble avoir un impact significatif :
- sur les propriétés des HDL (lipoprotéines de haute densité),
- sur la conformation de l'apoA-I, jouant un rôle clé dans la stabilisation de la structure des HDL.
Le gène APOA2 (1,7 kb) est localisé sur le chromosome 1q21-1q23.

Vous pouvez lire : Apolipoprotein A-II, a Player in Multiple Processes and Diseases (2022).
2. En tant que composant des HDL, l'apoA-II influence le métabolisme des lipides.
L'apoA-II a beaucoup été étudiée chez la souris, mais les protéines apoA-II humaines et murines ont des propriétés et des rôles différents, en partie parce que l'apoA-II humaine est dimère alors que l'homologue murin est un monomère.
Structure de l'apoA-II
L'apoA-II humaine est une protéine glycosylée synthétisée principalement dans le foie et dans une moindre mesure dans l'intestin en tant que précurseur pré-pro-apoA-II contenant 100 résidus d'acides aminés (Role of apoA-II in lipid metabolism and atherosclerosis: advances in the study of an enigmatic protein 2001).
- La concentration plasmatique de l'apoA-II humaine est d'environ 25 à 40 mg/dl et sa demi-vie est de quatre jours.
- Les niveaux d'apoA-II sont inversement associés aux risques de maladie coronarienne (Apolipoprotein A-II Is Inversely Associated With Risk of Future Coronary Artery Disease 2007).

(Figure : vetopsy.fr d'après Florea et coll)
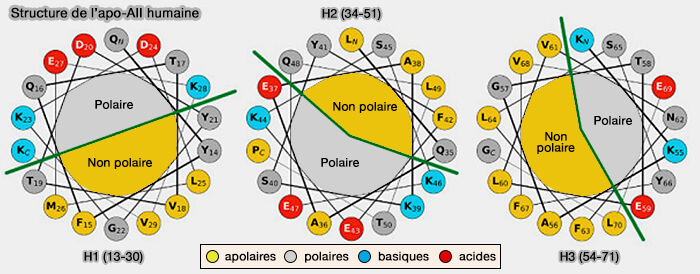
1. L'apoA-II humaine, comportant 77 résidus, contient trois hélices α amphipathiques en tandem :
- H1, i.e. résidus 13–29, relié par un β turn 30-34 à,
- H2, i.e. 34–51, relié par un β turn 49-53 à,
- H3, i.e. 54–71.
H3 est plus hydrophobe que les deux premières hélices et confère au domaine C-terminal une affinité de liaison aux lipides supérieure à celle du domaine N-terminal.
- Cette liaison aux phospholipides (PL) implique, en plus de la troisième hélice, le deuxième virage β, qui comprend la partie N-terminale de la deuxième hélice α.
- En revanche, dans les apolipoprotéines apoA-I et apoE, seul le domaine C-terminal est requis pour l'association avec les lipides.
Les hélices de l'apoA-II sont plus hydrophobes, environ 50% de la surface, et moins amphipathiques que celles formées par l'apoA-I, seulement 30%. Cette particularité peut avoir d'importantes implications fonctionnelles.
(Figure : vetopsy.fr d'après Florea et coll)
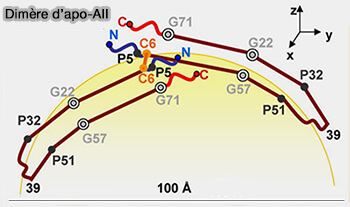
2. L'apoA-II contient une cystéine (C6) qui permet l'homodimérisation, mais aussi l'hétérodimériaation avec :
- l'apoE,
- l'apoD (apoA-III).
Lors du chargement de lipides, la protéine pro-apoA-II, 82 résidus se dimérise et est sécrétée en dehors de la cellule (The Structure of Apolipoprotein A-II in Discoidal High Density Lipoproteins 2007).
(Figure : vetopsy.fr d'après Gao et coll)
LCAT (Lécithine-Cholestérol AcylTransférase) participe à la fusion des particules LpAI avec les particules LpAII et, par conséquent, des particules LpAI:AII sont formées (Structural stability and functional remodeling of high-density lipoproteins 2015).
Le clivage post-traductionnel de la pro-apoA-II conduit à la forme mature de l'apoA-II, constituée de 77 résidus d'acides aminés à la suite de la protéolyse du pro-peptide ALVRR du domaine N-terminal.
L'arginine, l'histidine et le tryptophane sont absents de la séquence de l'apoA-II humaine mature.
Les modifications post-traductionnelles de l'apoA-II comprennent :
- la O-glycosylation de Thr42, qui influençait l'affinité pour les lipides, la sécrétion,, i.e. augmentation du le temps de séjour dans l'appareil de Golgi et aide au repliement, l'association avec les différents types de particules HDL et à la clairance des HDL (The known unknowns of apolipoprotein glycosylation in health and disease 2022),
- la phosphorylation de Ser 54 et Ser 68,
- l'oxydation de Met 49,
- la sialylation, i.e. ajout d'acide sialique.
3. L'apoA-II présente série d'isoformes qui ne diffèrent qu'à partir du 75ème résidu, i.e. -ATQ,,- AT ou- A (
Fonctions physiologiques de l'apoA-II
Par interaction avec d'autres apolipoprotéines et molécules, l'apoA-II est impliquée dans une série de processus, parmi lesquels les plus importants sont :
Remodelage des HDL
Les particules HDL subissent un remodelage continu dans le plasma.
(Figure : vetopsy.fr d'après Gao et coll)
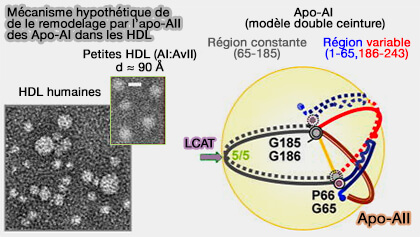
1. En ce qui concerne la teneur en apoA-I et apoA-II, les HDL peuvent être classées en deux sous-populations qui diffèrent par leur stabilité structurelle et leur devenir métabolique (Bioinformatic Analysis of Plasma Apolipoproteins A-I and A-II Revealed Unique Features of A-I/A-II HDL Particles in Human Plasma 2016).
a. Les LpAI:AII contenant apoA-I et apoA-II sont impliquées dans le transport des lipides (
b. les LpAI contenant uniquement de l'apoA-I interviennent aussi dans bien d'autres processus (
2. L'ApoA-II est liée aux particules HDL de manière plus stable que l'apoA-I et, selon sa concentration, elle peut déplacer l'apoA-I des particules HDL., i.e. ce qui aurait pour effet de diminuer l'activité de la CETP (Cholesteryl ester (CE) Transfer Protein) et de la PLTP (Phospholipid transfer protein).

Bien que le rôle structurel et fonctionnel de l'apoA-II soit sujet à débat, le consensus est que l'apoA-II peut entraver le remodelage métabolique des HDL et moduler leur métabolisme indirectement en influençant la conformation de l'apoA-I.
Modèle structurel hypothétique

Un modèle structurel est expliqué dans : Structural stability and functional remodeling of high-density lipoproteins (2015).
1. L'apoA-II humaine circule presque exclusivement sur les HDL de taille moyenne et entrave le remodelage des HDL in vivo (Role of Apolipoprotein A-II in the Structure and Remodeling of Human High-Density Lipoprotein (HDL): Protein Conformational Ensemble on HDL 2012).
(Figure : vetopsy.fr d'après Kido et coll)
a. Sur les petites HDL sphériques, la région variable de la double ceinture apoA-I fournit la courbure 2D et la couverture de surface adéquate, ne laissant aucune place à l'apoA-I.
b. Sur les HDL de taille moyenne, la région variable de l'apoA-I sort du plan de la double ceinture, libérant la surface pour lier des molécules de protéines supplémentaires telles que le monomère apo-AI ou l'homodimère apoA-II.
La longueur de l'homodimère apoA-II, i.e. 77 résidus, correspond le mieux à la région variable de l'apoA-I dans la double ceinture de taille moyenne, i.e. environ 85 résidus.
2. Ceci expliquerait la préférence de l'apoA-II pour les HDL plasmatiques humaines de taille moyenne.
- L'apoA-II est trop courte pour correspondre à la moitié variable ou constante entièrement développée de l'apoA-I sur les grands HDL, i.e. environ 120 résidus.
- L'apoA-II sur les LpAI:AII entrave le changement conformationnel de l'apoA-I, de la taille moyenne relativement compacte à la grande double ceinture entièrement déployée (Differential stability of high-density lipoprotein subclasses: Effects of particle size and protein composition 2009).
Ces particules LpAI:AII sont stables et peut-être métaboliquement moins actives avec une quantité constante fixe de lipides.
3. L'effet de l'apoA-II sur le HDL humain serait plus nuancé que le simple verrouillage de l'apoA-I dans la conformation de taille moyenne.
a. L'apoA-II entrave l'expansion de l'apoA-I de la ceinture à boucle de taille moyenne à la grande ceinture double.
Cet effet est, au moins en partie, médié par les lipides, et ne nécessite pas nécessairement des interactions directes entre les deux protéines, même si de telles interactions ne peuvent être exclues (Apolipoprotein A-II-mediated Conformational Changes of Apolipoprotein A-I in Discoidal High Density Lipoproteins 2012).
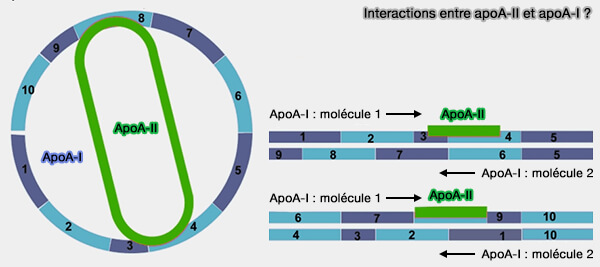
(Figure : vetopsy.fr d'après Gauthamadasa et coll)
b. L'expansion progressive de la double ceinture apoA-I à un diamètre approchant 12 nm perturbe les contacts de fermeture de ceinture entre les extrémités N et C, conduisant à la rupture des HDL et à la libération de lipides centraux.
Cela suggère que l'effet stabilisant de l'apoA-II sur les HDL sphériques peut, au moins en partie, résulter de l'expansion altérée de la double ceinture apoA-I sur les HDL(A-I/A-II).
c. La liaison de l'apoA-II exogène à la surface du HDL peut induire la contraction et, finalement, la dissociation de l'apoA-I dans un état compact pauvre en lipides ou sans lipides (Folded Functional Lipid-Poor Apolipoprotein A-I Obtained by Heating of High-Density Lipoproteins: Relevance to HDL Biogenesis 2012).
Formation des LpAI:AII
1. Bien que la majeure partie de l'apoA-II plasmatique circule sur les HDL sphériques (AI:AII), une petite quantité est présente sur les HDL discoïdes naissants (AII), une forme transitoire dans laquelle l'apoA-II est sécrétée (Apolipoproteins A-I, A-II and E are independently distributed among intracellular and newly secreted HDL of human hepatoma cells 2009).
a. La synthèse de l'apoA-II et sa lipidation initiale se produisent dans le réticulum endoplasmique (RE).
Dans l'appareil de Golgi, les particules d'apo-II sont davantage lipidées et se rapprochent de la taille des HDL plasmatiques humaines.
b. L'ApoA-II, qui se dimérise peu de temps après la lipidation, est sécrétée sous forme de dimère associé aux lipides sur des particules qui ne contiennent pas d'apoA-I.
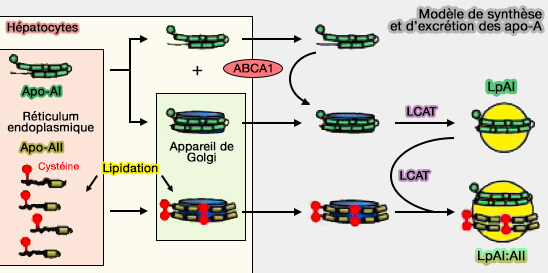
(Figure : vetopsy.fr d'après Gillard et coll)
2. Les particules d'apoA-I, plus petites, environ la moitié de l'apoA-I intracellulaire restant sans lipides.
- Après la sécrétion, l'apoA-I sans lipides acquiert des lipides par interaction avec ABCA1.
- La LpAI discoïde naissante mûrit en LpAI sphérique par l'action de LCAT et d'autres protéines de remodelage.
3. Les HDL naissantes (AII) fusionnent rapidement avec les HDL(AI) naissantes pour former des HDL sphériques matures(AI/AII) via l la LCAT (Lécithine-Cholestérol AcylTransférase).
- Cette fusion rapide est facilitée par la stabilité structurelle relativement faible du HDL(AII) discoïde.
- L'apoA-II augmente la maturation de HDL en conférant une courbure de surface 2D au HDL sphérique (AI:AII).
En effet, contrairement aux HDL sphériques, les HDL discoïdes présentent une réduction progressive de la stabilité avec une augmentation du rapport apoA-II/apoA-I (Differential stability of high-density lipoprotein subclasses: Effects of particle size and protein composition 2009).
- Les hélices de l'apoA-II très hydrophobes s'insèrent plus profondément dans la monocouche de phospholipides que celles de l'apoA-I, ce qui pourrait stabiliser la surface 2D des HDL sphériques et, en outre, améliorer les interactions avec les lipides centraux.
- Par contre, dans les HDL discoïdes, une partie substantielle de la protéine est enroulée autour du bord de la bicouche phospholipidique plutôt qu'insérée à son sommet. Dans cette géométrie, les faces hélicoïdales apolaires relativement grandes de l'apoA-II ne confèrent pas nécessairement une stabilité HDL supplémentaire par rapport à celle conférée par l'apoA-I.

L'apoA-II augmente la formation des HDL sphériques de taille moyenne, mais entrave leur remodelage en grandes HDL chargées de lipides qui sont les ligands préférés du récepteur SR-BI des HDL
Efflux du cholestérol
L'efflux de cholestérol des tissus périphériques est la première étape de la voie RCT (transport inverse du cholestérol) ou voie de retour des lipides qui peut se produire :
- par diffusion passive (de manière non spécifique),
- par un mécanisme spécifique dépendant de l'énergie.
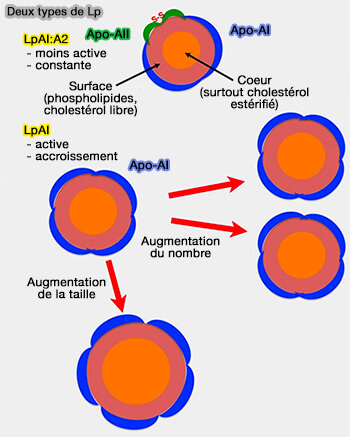
1. Les particules LpAI:AII favorisent un niveau supérieur d'efflux de cholestérol à LpAI par un mécanisme dépendant de ABCA1 (Apolipoprotein A-II alters the proteome of human lipoproteins and enhances cholesterol efflux from ABCA1 2017).
De nombreuses données obtenues avant l'an 2000 suggéraient le contraire le argumentant que l'apoA-I agissait sur les deux processus.
- La surexpression de la protéine apoA-II humaine entraîne, chez des souris transgéniques, la formation d'HDL plus petites et hétérogènes, associées à de faibles taux de cholestérol par rapport aux HDL du groupe témoin,
- La surexpression de l'apoA-I murine induit la formation d'HDL plus grosses, associées à des concentrations élevées de cholestérol, que celles du groupe témoin.
2. Certaines sous-fractions de HDL pourraient avoir un rôle important dans la prévention de l'athérosclérose par rapport à d'autres, et des modifications de ces sous-fractions pourraient affecter l'effet athérosclérotique des HDL, bien que le taux de HDL ne soit pas modifié ou soit même augmenté Rôles de l'apoA-II dans certaines pathologies
Rôle de l'apoA-II dans l'athérosclérose et les troubles cardiovasculaires
L'athérosclérose est une maladie chronique qui affecte les artères moyennes et grosses et survient à la suite de l'accumulation progressive de lipides dans l'intima des vaisseaux sanguins, en particulier des LDL (lipoprotéines de basse densité) qui sont oxydées (
Un faible taux de cholestérol des HDL est un facteur de risque de maladie coronarienne et qu'un taux élevé de cholestérol HDL est associé à un faible risque de développer une athérosclérose.

L'athérosclérose est décrite dans un chapitre spécifique.
(Figure : vetopsy.fr d'après Florea et coll)
Dans l'athérosclérose, il existe des modifications structurelles et fonctionnelles des HDL (High density lipoprotein: the role of apolipoprotein A2 2019).
1. L'effet athéroprotecteur des HDL a été expliqué par la présence de deux enzymes qui inhibent l'oxydation des IDL (lipoprotéines de densité intermédiaire) in vitro en détruisant les phospholipides (PL) biologiquement actifs des LDL oxydées.
a. La paraoxanase, PON1, i.e. hydrolase dépendante du calcium, est une protéine associée aux HDL qui a la capacité (Paraoxonase (PON)-1: a brief overview on genetics, structure, polymorphisms and clinical relevance 2018) :
- d'hydrolyser le cholestérol des LDL oxydées,
- de cliver la w.
La paraoxonase a une structure similaire à celle de l'apoM (
b. La PAF-AH (Platelet Activator Factor-Acétyl Hydrolase), EC 3.1.1.47 est une phospholipase qui hydrolyse le groupe acyle des acides gras à chaîne courte (SCFA) à la deuxième position des phospholipides, en particulier du PAF, i.e. puissant activateur des phospholipides (PL) et médiateur de nombreuses fonctions leucocytaires, de l'agrégation et de la dégranulation plaquettaires, de l'inflammation et de l'anaphylaxie (P Platelet-Activating Factor Acetylhydrolase 2016).
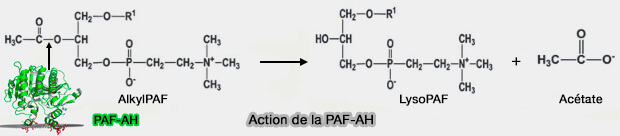
(Figure : vetopsy.fr)
2. Le HDL dysfonctionnel contient des niveaux inférieurs d'apoA-I et de paraoxonase, perdant à la fois sa capacité antioxydante et anti-inflammatoire ainsi que sa capacité à favoriser l'efflux de cholestérol (Dysfunctional HDL and atherosclerotic cardiovascular disease 2016).
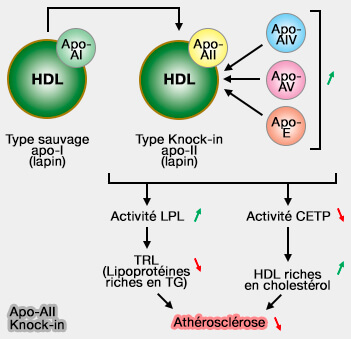
(Figure : vetopsy.fr d'après Koioke et coll)
a. Des expériences sur des lapins transgéniques, i.e. les souris ne possèdent pas de CETP (Cholesteryl Ester (CE) Transfer Protein) et les lapins sauvages manquent d'apoA-II endogène, ont montré que l'enrichissement des HDL par l'apoA-II augmentait l'activité d'efflux de cholestérol et les fonctions anti-inflammatoires des HDL (Human Apolipoprotein A-II Protects Against Diet-Induced Atherosclerosis in Transgenic Rabbits 2009).
b. Des lapins, dans lesquels l'apoA-I endogène a été remplacée par l'apoA-II humaine, présentaient de faibles taux de triglycérides plasmatiques grâce à (Human apolipoprotein A-II reduces atherosclerosis in knock-in rabbits 2021) :
- une clairance accrue des TRL (lipoprotéines riches en triglycérides),
- une activité élevée de LPL (LipoProtéine Lipase) par rapport aux lapins témoins,
- une augmentation des taux de cholestérol des HDL,
- un enrichissement des HDL enrichies en apoE, apoA-IV et apoA-V.
3. Chez les humains, l'apoA-II est inversement associée au risque de future maladie coronarienne.
L'étude CARDIA (Coronary Artery Risk Development in Young Adults) publiée récemment a indiqué des associations spécifiques entre l'apoA-I et l'apoA-AII et les paramètres cardiométaboliques (Spectrum of Apolipoprotein AI and Apolipoprotein AII Proteoforms and Their Associations With Indices of Cardiometabolic Health: The CARDIA Study 2021).
Le rapport apoA-II/apoB serait un meilleur paramètre pronostique de l'athéroscléose (ApoA-I/A-II-HDL positively associates with apoB-lipoproteins as a potential atherogenic indicator 2017).

Les LpAI sont considérées comme davantage responsables des propriétés anti-athérogènes des HDL et les LpAI:A-II représentent plutôt un indicateur athérogène.
Rôle de l'apoA-II dans d'autres pathologies
L'apoA-II a un rôle dans d'autres pathologies (Apolipoprotein A-II, a Player in Multiple Processes and Diseases 2022) :
- dans le syndrome métabolique avec l'altération d'autres apolipoprotéines (apoC-II, apoC-III et apoE), la résistance à l'insuline, l'obésité et le diabète de type 2 (Apolipoprotein serum levels related to metabolic syndrome in patients with schizophrenia 2019),
- dans l'immunité (LpA-II:B:C:D:E: a new immunochemically-defined acute phase lipoprotein in humans 2018),
- dans la détection du cancer, en particulier pancréatique (Potential usefulness of apolipoprotein A2 isoforms for screening and risk stratification of pancreatic cancer 2016),
- dans l'amyloïdose (Systemic amyloidosis from A (AA) to T (ATTR): a review 2020 et Hereditary Renal Amyloidosis Associated With a Novel Apolipoprotein A-II Variant 2021),
- dans la maladie d'Alzheimer (Levels of Angiotensin-Converting Enzyme and Apolipoproteins Are Associated with Alzheimer’s Disease and Cardiovascular Diseases 2021).
Retour aux apolipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


