Glucides : dérivés des oses
Glycosaminoglycanes (GAG)
Structure et
classification
- Biologie cellulaire et moléculaire
- Biochimie

Les glycosaminoglycanes (GAG) sont de longs polysaccharides linéaires constitués d'unités disaccharidiques répétitives.
Vue d'ensemble
1. Les GAG sont aussi appelés mucopolysaccharides acides à cause de :
- leur forte capacité de rétention de l'eau, i.e. muco,
- leur nature glucidique, i.e. polysaccharides,
- leur acidité provenant de leurs multiples charges négatives.

Les GAG sont des composants essentiels des matrices extracellulaires des tissus conjonctifs.
2. Historiquement, comme les GAG sont des molécules très polaires qui attirent l'eau, on pensait qu'ils ne servaient que comme lubrifiants, amortisseurs ou structures d'échafaudage.
Toutefois, les GAG jouent un rôle clé dans la signalisation cellulaire pour moduler une grande quantité de processus biochimiques, comme, entre autres :
- la régulation de la croissance et de la prolifération cellulaire,
- l'adhésion cellulaire,
- la réparation des plaies,
- l'effet anticoagulant.
Structure générale des GAG
Les GAG sont des polymères acides linéaires, chargés négativement, composés :
- de plusieurs dizaines ou centaines de répétitions d’unités disaccharidiques diversement sulfatées,
- d'un lien GAG/protéine pour former des protéoglycanes (
lien GAG/protéine), excepté pour l'acide hyaluronique (HA).
Unités disaccharidiques
1. En général, l'unité répétitive à deux oses est constituée :
- d'un acide uronique, i.e. dérivant des aldoses par oxydation de la fonction alcool primaire ($\ce{-CH2OH}$), i.e. acide glucuronique (GlcA) ou acide iduronique (IdoA),
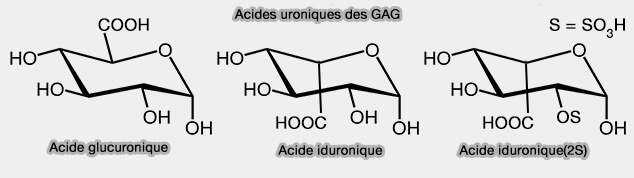
(Figure : vetopsy.fr)
- d'une osamine (amino sugar en anglais), i.e. dérivant des oses par le remplacement d'un groupe hydroxyle ($\ce{-OH}$) par un groupe amine ($\ce{-NH2}$), i.e. N-acétyl-D-glucosamine (GlcNAc) ou N-acétyl-D-galactosamine (GalNAc).
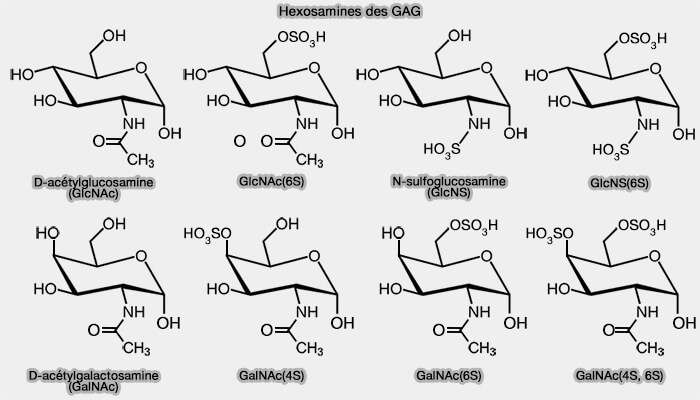
(Figure : vetopsy.fr)
Toutefois, le sulfate de kératane utilise un galactose (Gal) à la place de l'acide uronique.
2. Par contre, les GAG présentent une hétérogénéité structurelle au sein de la molécule de polysaccharide selon :
- leur masse moléculaire,
- leur structure disaccharidique,
- leur sulfatation.
a. Les GAG possèdent des sous-domaines qui permettent des interactions biologiquement importantes avec une grande variété de protéines régulatrices.
b. Les épimérisations et les sulfatations le long des chaînes favorisent les interactions ioniques avec les facteurs de croissance et d'autres molécules de signalisation, régulant ainsi :
- le développement et la différenciation, mais aussi les cancers,
- les mécanismes immunologiques.
3. L'étude des relations structure/fonction des GAG est ardue.
- D'une part, la synthèse dynamique des GAG est constamment modulée par les enzymes présentes à leurs côtés.
- D'autre part, les réactions enzymatiques de sulfatation et d'épimérisation ne sont pas complètes, ce qui entraîne une hétérogénéité structurelle au sein même de la molécule de polysaccharide.
Classification des GAG
1. Les GAG sont classés en quatre groupes, en fonction de leurs structures disaccharidiques centrales (Determinants of Glycosaminoglycan (GAG) Structure 2015) :
- l'héparine/héparane sulfate (HS),
- la chondroïtine sulfate (CS)/dermatane sulfate (DS),
- le kératane sulfate (KS),
- l'hyaluronane ou acide hyaluronique (HA).
Les terminaisons françaises parlent de sulfate de…, i.e. sulfate d'héparane, nous utiliserons le terme anglicisé, i.e. héparane sulfate.
2. Le tableau suivant résume les principales propriétés structurales des GAG.
S signifie sulfatation, i.e. 4S sur C4, 6S sur C6
| Nom | Acide uronique | Héxosamine | Lien | Caractéristiques |
|---|---|---|---|---|
| Héparine (Hep) |
|
|
-IdoUA(2S)α1- 4GlcNS(6S)α1-4 |
Charge négative la plus élevée (toutes molécules biologiques connues) |
| Héparane sulfate (HS) |
|
|
-GlcUAβ1- 4GlcNAcα1-4 |
|
| Chondroitine sulfate (CS) |
|
|
GlcUAβ(1→3) GalNAcβ(1→4) |
GaG le plus répandu |
| Dermatane sulfate (DS) |
|
|
'IdoUAβ1- 3'GalNAcβ1-4 |
Présence d'IdoU |
| Kératane sulfate (KS) |
|
|
-Gal(6S)β1- 4GlcNAc(6S)β1-3 |
Kératane sulfate II est fucosylé |
| Acide hyaluronique Hyaluronane (HA) |
GlcA | GlcNAc | -GlcUAβ1-3GlcNAcβ1-4 |
|


