Glucides : dégradation du glucose
Glycolyse ou voie d'Embden-Meyerhof
Régulation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La glycolyse (voie d'Embden-Meyerhof-Parnas) est régulée par l'oxygène, les taux de glucose-6-phosphate, d'ATP, d'AMP et de fructose-2,6-bisphosphate.
La production d'énergie à partir du glucose est esentiellement assurée par la voie d'Embden-Meyerhof.
$\ce{Glucose + 2 NAD+ + 2 ADP + 2 Pi}$ $\longrightarrow$ $\ce{pyruvate + 2 NADH + 2 H+ + 2 ATP + 2 H2O}$
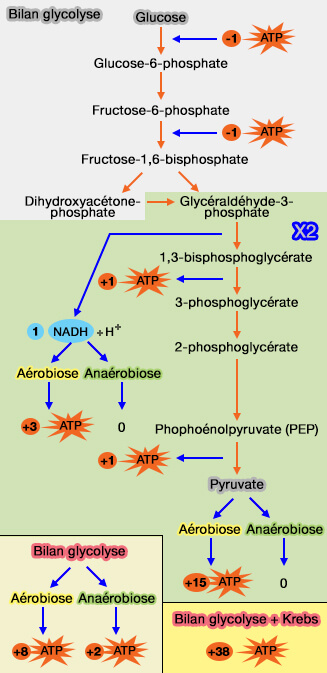
(Figure : vetopsy.fr)
La glycolyse est régulée par plusieurs facteurs qui interagissent avec les enzymes des trois réactions principales :
- la phosphorylation du glucose en glucose-6-phosphate (
réaction 1), catalysée par l'hexokinase et la glucokinase ;
- la formation de fructose-1,6-bisphosphate (
réaction 3), catalysée par la phosphofructokinase 1 (PFK-1), régulation étudiée dans le rôle de l'ATP et l'AMP,
- la formation du pyruvate (
réaction 10), catalysée par la pyruvate kinase (PK), régulation étudiée dans le même chapitre.
Rôle du glucose-6-
phosphate
Même si l'hexokinase et la glucokinase catalysent la même réaction, leur régulation est complètement différente.
1. L'hexokinase est inhibée par :
- le glucose-6-phosphate, régulation essentielle de la glycolyse (
réaction 1) : c'est un effecteur inhibiteur allostérique,
- le phosphoénolpyruvate ou PEP (
réaction 9),
- l'acétyl-CoA.
2 La glucokinase, étroitement spécifique du glucose, est essentiellement hépatique, mais aussi pancréatique, et intervient de façon efficace que lorsque le taux de glucose sanguin est élevé, par exemple après un repas.
- Son affinité pour le glucose est beaucoup plus faible que celle de l'hexokinase (KM égale à 10 mM).
- Elle n'est pas régulée comme l'hexokinase, et en particulier pas par le glucose-6-phosphate.
a. Du point de vue hépatique,
- lors d'hyperglycémie, le foie utilise la glucokinase pour transformer le glucose en glucose-6-P pour la glycogénogenèse (stockage du glucose sous forme de glycogène),
- lors d'hypoglycémie, le glucose sera métabolisé par d'autres organes grâce à l'héxokinase car la glucokinase est inactive.
b. Du point de vue pancréatique, l'hyperglycémie provoque la transformation du glucose en glucose-6-P par la glucokinase, ce qui induira la sécrétion d'insuline (hormone hypoglycémiante).
Rôle de l'ATP et de l'AMP
La glycolyse est sous la dépendance de l'ATP qui exerce une inhibition sur plusieurs réactions.
Rôle sur la phosphofructokinase
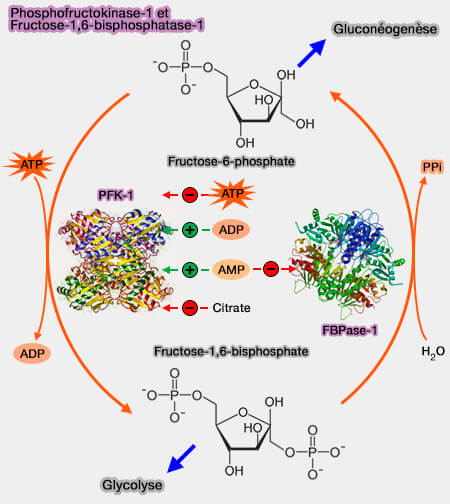
1. Tout d'abord, l'ATP inhibe allostériquement la phosphofructokinase 1 ou PFK-1 (
$\ce{Fructose-6-phosphate} + ATP$ $\longrightarrow$ $\ce{fructose-1,6-bisphosphate + ADP}$
Remarque : rappelons que l'allostérie, pour une enzyme, modifie son activité lorsque sa structure spatiale tertiaire ou quaternaire est transformée par une molécule organique fixée à un site différent du site actif de l'enzyme.
C'est l'ATPlibre, i.e. non complexé avec le magnésium, qui se fixe sur le site régulateur et régule la phosphofructokinase, et non celui qui se fixe sur le site actif.
2. L'AMP, par contre, joue le rôle d'effecteur activateur allostérique, i.e. il augmente l'activité de l'enzyme pour son substrat.
- Le rapport ATP/AMP doit rester dans une fourchette étroite, entre 0,7 et 0,95 (
charge énergétique de la cellule).
- Si cette charge est faible, i.e. trop peu d'ATP ou trop d'AMP, la cellule aura recours à la glycolyse pour l'augmenter et inversement.
(Figure : vetopsy.fr)
3. La phosphofructokinase est régulée aussi :
- positivement par l'ADP, le fructose-1,6-bisphosphate et le fructose-2,6-bisphosphate,
- négativement par le phosphoénolpyruvate ou PEP (
réaction 9), le citrate du cycle de Krebs, le NADH (
réaction 6).
Autres rôles
1. L'ATP est également inhibiteur de la pyruvate kinase (PK), alors que le fructose-1,6-bisphosphate l'active.
2. L'AMP, quant à lui, à part son rôle sur la phosphofructokinase, est un inhibiteur de la fructose-1,6-bisphosphatase ou FBPase-1 (EC 3.1.3.11) qui catalyse la réaction, nécessitant des cations bivalents comme $\ce{Mg++}$ ou $\ce{Mn++}$ .
$\ce{Fructose-1,6-bisphosphate} + H20$ $\longrightarrow$ $\ce{fructose-6-phosphate + Pi}$
Cette réaction est donc l'inverse de celle de la phosphofructokinase et est retrouvée dans la gluconéogenèse, le cycle de Calvin de la photosynthèse et la voie des pentoses phosphates.

L'activité soutenue de la phosphofructokinase induit forcément la diminution de l'activité de la fructose-1,6-bisphosphatase et réciproquement.
- En aérobiose, l'augmentation du taux d'ATP inhibe la glycolyse et active la gluconéogenèse.
- En anaérobiose, l'augmentation de la concentration en AMP active la glycolyse et inhibe la gluconéogenèse.
3. On pourrait aussi parler du rôle de l'oxygène qui diminue la vitesse de la glycolyse (effet Pasteur) et cet effet est évident suite au bilan énergétique (2 ATP en anaérobiose contre 38 ATP En aérobiose,
- En présence d'oxygène, la cellule aérobie utilise moins de glucose pour produire de l'énergie.
- En l'absence d'oxygène, la concentration d'ATP diminue, ce qui a pour conséquence d'augmenter celle de l'AMP (cf. ci-dessous).
Rôle du fructose-2,6-bisphosphate
Vue d'ensemble
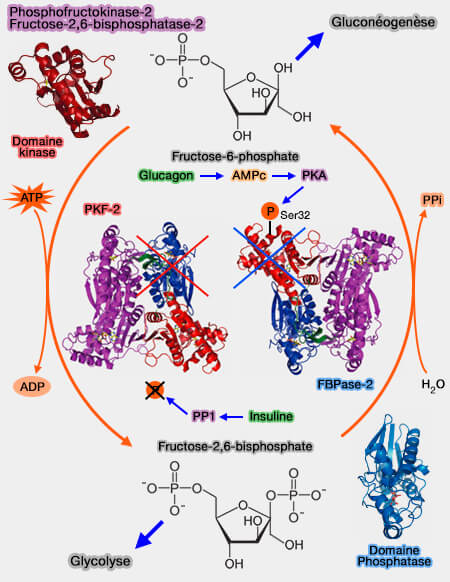
Le fructose-2,6-bisphosphate intervient aussi dans le métabolisme du glucose par l'intermédiaire de la phosphofructokinase 2 (PFK-2) ou fructose-bisphosphatase 2 (FBPase-2), EC 2.7.1.105.
PFK-2 fait partie des phosphofructokinases, qui comprennent aussi la phosphofructokinase 1 (PFK-1).
1. Comme son nom l'indique, cette enzyme est dotée à la fois d'une activité :
- kinase : $\ce{Fructose-6-phosphate} + ATP$ $\longrightarrow$ $\ce{fructose-2,6-bisphosphate + ADP}$
- phosphatase : $\ce{Fructose-2,6-bisphosphate} + H2O$ $\longrightarrow$ $\ce{fructose-6-phosphate + Pi}$
(Figure : vetopsy.fr)
Quatre isozymes sont retrouvées chez l'homme :
- PFKFB-1 dans le foie, les muscles et le foetus,
- PFKFB2 dans le muscle cardiaque,
- PFKB3 dans le cerveau, le placenta et inductible,
- PFKB4 dans le testicule.

Le fructose-2,6-bisphosphate inhibe la fructose-1,6-bisphosphatase pour stimuler la glycolyse.
2. Le fructose-2,6-bisphosphate est essentiel dans la glycolyse et la gluconéogenèse parce que sa synthèse est régulée par :
- les voies hormonales ayant un système de transduction à AMPc, comme, ici, le glucagon et l'adrénaline par son récepteur β…
- la PKA (Protéine Kinase AMPc-dépendante),
- la PP1 (protéine-phosphatase-1) qui joue un rôle essentiel dans la régulation des taux de glucose sanguin et le métabolisme du glycogène.
Mécanisme
La PFK-2/FBPase-2 est phosphorylée-déphosphorylée sur sa Ser32.
1. Le site kinase est inactivé par phosphorylation.
Le glucagon active la formation de l'AMPc qui, à son tour, active la PKA qui phosphoryle la Ser32 PFK-2/FBPase-2.
- La formation du fructose-2,6-bisphosphate est inhibée et sa dégradation stimulée.
- La fructose-1,6-bisphosphatase est alors active, inhibe la glycolyse et stimule la gluconéogenèse, ce qui provoque une augmentation de la glycémie (teneur en glucose dans le sang).
2. Le site phosphatase est inactivé par la déphosphorylation par la PP1 sur la Ser32 de la PFK-2/FBPase-2.
- Cette déphosphorylation est induite par la liaison de l'insuline à son récepteur (IR, Insulin Receptor), appartenant à la famille des récepteurs de facteurs de croissance à activité tyrosine kinase.
- Ce processus diminue la glycémie.
Dans le foie, ce mécanisme fonctionne de manière synchronisée avec la régulation du glycogène par cette PP1 qui est liée à la glycogène phosphorylase, capteur de glucose dans les cellules hépatiques, qui catalyse la réaction (
$\ce{(Glucose)_n + Pi}$ $\longrightarrow$ $\ce{glucose_{n-1} + glucose-1-phosphate}$
Remarque : les
peroxysomes ont aussi un rôle dans le catabolisme des glucides (


