Trafic vésiculaire : endocytose clathrine-dépendante (CME)
Recrutement de l'actine
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
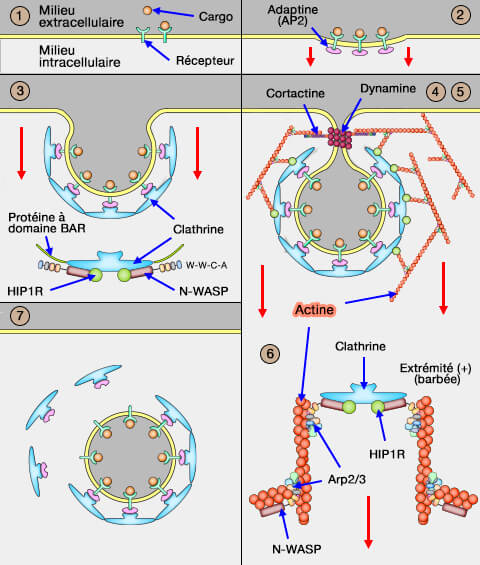
(Figure : vetopsy.fr)
4. L'approfondissement de cette dépression et le rétrécissement de son goulot forme une poche profondément invaginée, grâce au recrutement des NPF (Nucleation Promoting Factor), du complexe Arp2/3 et de la polymérisation de l'actine.
Cytoskeleton-mediated membrane reshaping in endocytosis dessin à voir
4. Recrutement
de l'actine
L'actine s'auto-assemble par polymérisation en longs filaments qui poussent contre la membrane, la tirant vers l'intérieur.
Vue d'ensemble

La plus grande partie de ce chapitre est tiré de : Principles of self-organization and load adaptation by the actin cytoskeleton during clathrin-mediated endocytosis (2020).
La force nécessitant l'internalisation des puits recouverts de clathrine (CCP) s'exerce dans deux régions :
- une à la base du puits pour la polymérisation de l'actine contre la membrane plasmique,
- la seconde sur le revêtement du puits par la fixation des filaments d'actine en croissance afin que les forces soient transmises au puits pour entraîner l'intériorisation.
Dans la migration cellulaire, la force au niveau de la membrane plasmique est suffisante (Force Feedback Controls Motor Activity and Mechanical Properties of Self-Assembling Branched Actin Networks 2016).
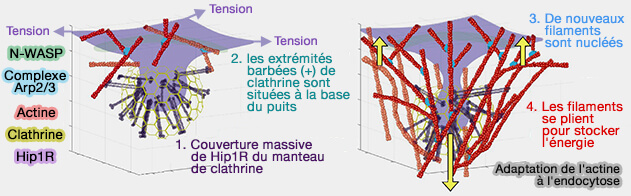
(Figure : vetopsy.fr d'après Akamatsu et coll)
1. Les protéines à domaine BAR (et d'autres cf. figure) et la cage de clathrine recrutent les NPF (Nucleation Promoting Factor) qui activent le complexe Arp2/3, nécessaire pour la polymérisation de l'actine (
- L'activité du complexe Arp2/3 en dessous de son taux de nucléation basale de 1 filament par seconde inhibe l'endocytose in vitro.
-
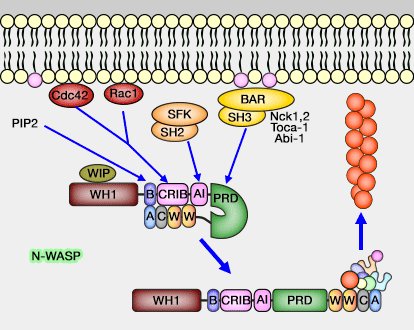
Exemple simplifié de la régulation de N-WASP
(Figure : vetopsy.fr)

Les NPF, le complexe Arp2/3 et la polymérisation de l'actine sont traités dans des chapitres spéciaux.
2. Les protéines Hip1, Hip1R et les epsines 1/2/3 se lient de manière coopérative aux filaments d'actine du puit recouvert de clathrine (CCP) pour transmettre les forces (Molecular basis for coupling the plasma membrane to the actin cytoskeleton during clathrin-mediated endocytosis 2012).
Par exemple, la suppression de Hip1R dans les cellules HeLa inhibe l'endocytose. Un phénomène identique se produit avec les epsines (Epsin deficiency impairs endocytosis by stalling the actin-dependent invagination of endocytic clathrin-coated pits 2014).
(Figure : vetopsy.fr)
La ségrégation spatiale de l'activation du complexe Arp2/3, et des protéines de liaison sur la couche de clathrine génère une force efficace orthogonale à la base du puits plutôt que de produire une force de pincement sur le cou (
Ancrage de l'actine
L'ancrage efficace des microfilaments d'actine à la surface du puits recouvert de clathrine (CCP) dépend de la distribution des protéines de liaison sur la surface du puits.
Ces protéines, et la liste ne semble pas exhaustive, sont :
- Hip1 (Huntingtin-interacting Protein 1) and Hip1R (Hip1-related Protein),
- les epsines, étudiées dans les adaptateurs,
- FCHSD2 (FCH and double SH3 domains protein 2), en liaision avec les phosphoinositides, et en particulier PI(3,4)P2 (
cf. plus bas).
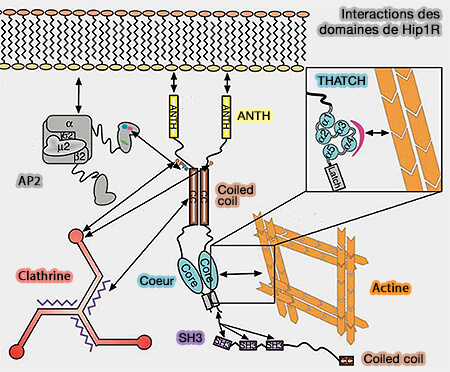
Hip1 et Hip1R
Un nombre seuil d'Hip1 (Huntingtin-interacting Protein 1) and Hip1R (Hip1-related Protein) ou d'epsines est nécessaire à l'internalisation des puits recouverts de clathrine (CCP), le seuil apparaît nécessaire pour permettre une capture efficace des microfilaments d'actine par le manteau et une transmission de force du réseau d'actine au puits.
(Figure : vetopsy.fr d'après Brett et coll)
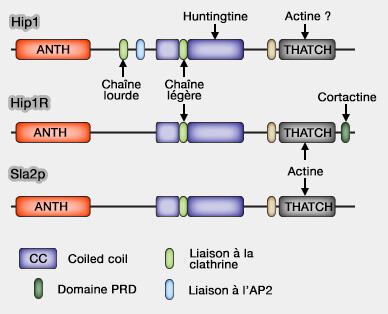
1. Hip1 (Huntingtin-interacting protein 1), surtout neuronal, et Hip1R (HIP1-related) se lient à la clathrine.
Vous pouvez lire : Heat shock cognate protein 70 (HSC70) est un nouveau partenaire pour la protéine HIP1R (2011) et Endocytic Adaptor Protein HIP1R Controls Intracellular Trafficking of Epidermal Growth Factor Receptor in Neuronal Dendritic Development (2018).
2. Ces protéines contiennent plusieurs domaines.
a. Le domaine ANTH (AP180/CALM - Clathrin Assembly Lymphoid Myeloid Leukemia -NH2-terminal homology) se lie au PI(4,5)P2 ou PIP2 de la membrane.
Le domaine ANTH est presque identique :
b. Une boîte à clathrine, i.e. LMDMD, forme un domaine de liaison à la chaîne lourde de la clathrine et à l'AP-2 (FxDxF et DPF) pour Hip1.
Hip1R ne possède pas de site pour AP-2.
(Figure : vetopsy.fr d'après Brett et coll)
c. Un domaine coiled-coil (superhélice) central sert de liaison à la chaîne légère de la clathrine qui stimule l'assemblage de la clathrine (Actin Binding by Hip1 (Huntingtin-interacting Protein 1) and Hip1R (Hip1-related Protein) Is Regulated by Clathrin Light Chain 2008).
d. Un domaine USH (UpStream Helix) inhibe la liaison de l'actine par un mécanisme inhibiteur (Intrasteric Inhibition Mediates the Interaction of the I/LWEQ Module Proteins Talin1, Talin2, Hip1, and Hip12 with Actin 2004).
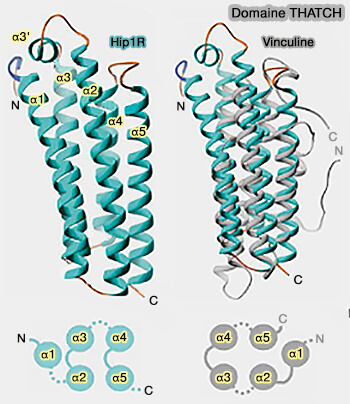
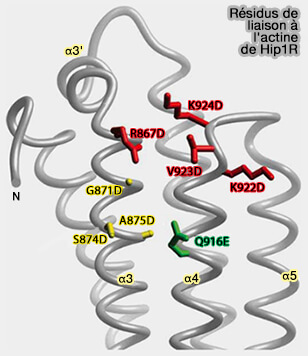
e. Le domaine THATCH (Talin-HIP1R/Sla2p-Actin-Tethering C-terminal Homology) se lie à l'actine (Structural definition of the F-actin-binding THATCH domain from HIP1R 2006).
Ce domaine THATCH comprend environ 200 résidus (773-962 dsans Hip1R) situés dans l'extrémité C-terminale de ces protéines (The structure of the C-terminal actin-binding domain of talin 2008).
- Il contient quatre blocs conservés et a été appelé aussi domaine I/LWEQ d'après les résidus des études initiales conservés des blocs 1-4 (I/L dans α, W dans α3, E dans α4 et Q dans le " latch ").
- Son noyau a une structure hélicoïdale composée de cinq longues hélices α antiparallèles (α1-α5) connectées par des boucles et une hélice α courtes (α3')
- Il se lie à la l'actine F et regroupe les filaments d'actine.
f. En outre, HI1PR comporte un domaine PRD C-terminal qui peut se lier au domaine SH3 de nombreux adaptateurs et de la cortactine (A Hip1R–cortactin complex negatively regulates actin assembly associated with endocytosis 2007) : cette liaison peut bloquer l'allongement des extrémités barbées des microfilaments d'actine.
(Figure : vetopsy.fr d'après Brett et coll)
HIp1 et HIP1R joue également un rôle dans les cancers du colon ou de la prostate, dans l'apoptose…
Mécanisme de l'ancrage de l'actine
L'ancrage efficace des microfilaments d'actine à la surface du puits recouvert de clathrine (CCP) dépend de la distribution des protéines de liaison sur la surface du puits.
1. D'une part, les protéines de liaison, i.e. Hip1, Hip1R et les epsines sont intégrées dans la couche de clathrine et doivent couvrir une surface suffisante pour fournir un levier pour l'internalisation (FerriTag is a new genetically-encoded inducible tag for correlative light-electron microscopy 2018 et Endocytic proteins are partitioned at the edge of the clathrin lattice in mammalian cells 2017).
Hip1R pourrait être dans une conformation étendue lorsqu'il interagit avec la membrane, la clathrine et l'actine, et dans une conformation plus courte/entortillée lorsqu'il n'est pas lié à la clathrine.
2. D'autre part, le rôle de la couverture de protéines de liaison dans la génération de force a également des implications pour la transition de la forme plate à la forme incurvée.
- Dans la phase plus précoce de l'endocytose, la membrane commence à se plier à partir d'un revêtement plat préassemblé ou se déforme continuellement lorsque le revêtement s'assemble (Endocytic sites mature by continuous bending and remodeling of the clathrin coat 2015 et Clathrin-adaptor ratio and membrane tension regulate the flat-to-curved transition of the clathrin coat during endocytosis 2018 et Membrane bending occurs at all stages of clathrin- coat assembly and defines endocytic dynamics 2018).
-
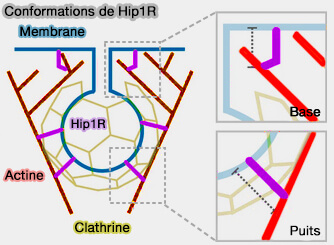
Conformations de Hip1R
(Figure : vetopsy.fr d'après Clarke et coll)
3. Enfin, l'ancrage de l'actine pourrait être favorisé par la protéine FCHSD2 qui a un double rôle car elle favorise la polymérisation de l'actine (
Polymérisation de l'actine
La polymérisation de l'actine est favorisé par :
- Arp2/3,
- des NPF (Nucleation Promoting Factor) comme N-WASP.
Complexe Arp/2/3
1. Le complexe Arp2/3 de nucléation polymérise l'actine G (
- en microfilaments disposés en réseau dans un angle de 70° entre filaments mère et filament fille (
nucléation de l'actine),
- très rapidement avec toutes les régulations inhérentes à ce processus (coiffe, élongation, fragmentation…).
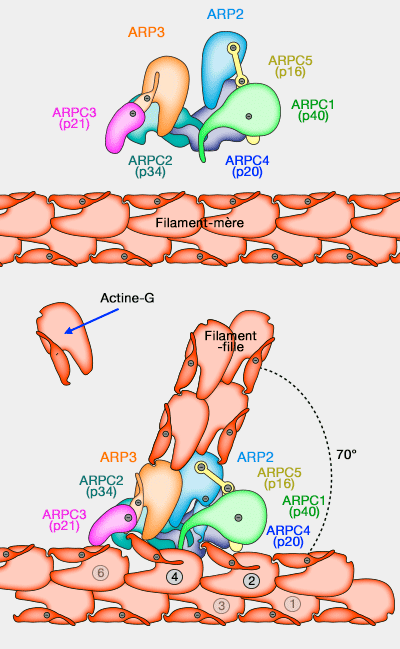
(Figure : vetopsy.fr d'après Rouiller et Volkman)
Les extrémités barbées (+) ciblent le col ou goulot (neck) des bourgeons d'endocytose : elles exercent leurs forces à ce niveau.
2. Il semble qu'environ 200 complexes Arp2/3 s'assemblent aux sites d'endocytose médiée par la clathrine dans les cellules humaines : ce processus serait suffisant pour internaliser les puits endocytaires contre la tension membranaire (Principles of self-organization and load adaptation by the actin cytoskeleton 2020).
- L'actine s'organise en un réseau ramifié radial avec des extrémités croissantes orientées vers la base du puits.
- De longs filaments d'actine se plient entre les sites de fixation dans le manteau et la base du puit.
3. Cette polymérisation provoque la courbure d'une fraction significative de microfilaments d'actine.
Remarque : la cortactine, par son domaine SH3, est recrutée par la dynamine grâce à son domaine PRD est aussi un facteur de nucléation puissante de l'actine (Cortactin Is a Component of Clathrin-Coated Pits and Participates in Receptor-Mediated Endocytosis 2003).
FCHSD2 et N-WASP
1. La fonction de FCHSD2 (FCH and double SH3 domains protein 2) pourrait double.
- Elle ancre l'actine sur la membrane avec sa liaison avec PI(3,4)P2.
- Elle favorise la polymérisation de l'actine.
2. Le mécanisme pourrait être le suivant (A Flat BAR Protein Promotes Actin Polymerization at the Base of Clathrin-Coated Pits 2018).
- a. L'intersectine est récrutée après l'initiation de la formation des puits recouvertes de clathrine, en particulier par les epsines, grâce à leur répétitions NPF (asparagine-proline-phenylalanine) qui reconnaissait le domaine EH (Eps15 Homology) de l'intersectine.
- b. FCHSD2 est recrutée par l'intersectine par son interaction entre les domaines SH3.
- c. FCHSD2 se lie avec PI(3,4)P2 sur la membrane alors plate autour des CCP (c1) et active la polymérisation de l'actine via N-WASP, membre des NPF (Nucleation Promoting Factor) (c2)
- d. La polymérisation de l'actine achève l'endocytose.
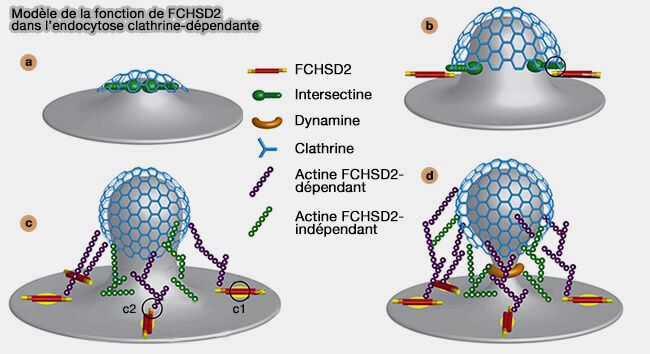
(Figure : vetopsy.fr d'après He et coll)
Remarque : l'augmentation membranaire de PI(3,4)P2 annoncerait le déhabillage de la vésicule et et entraînerait l'arrivée de la petite GTPase Rab5 régulateur principal de la dynamique des endosomes précoces.
Ancrage, polymérisation de l'actine et énergie élastique
Lors de la polymérisation de l'actine, l'énergie élastique stockée dans des filaments courbés contribue à l'internalisation endocytaire (
1. Une fraction significative de microfilaments d'actine se plie sous la force générée par la polymérisation et contribue au succès de l'internalisation endocytaire d'au moins deux manières.
- Ils pourraient contribuer à empêcher le recul du puits recouvert de clathrine (CCP).
- Ces filaments courbés stockent de l'énergie élastique pour la production de force ultérieure, tout comme la perche d'un sauteur.
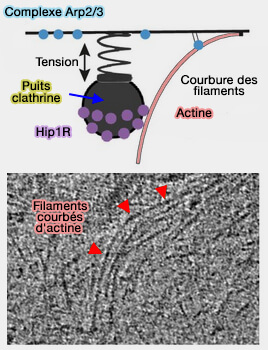
(Figure : vetopsy.fr d'après
Akamatsu et coll)
Ces filaments courbés contribuent à l'internalisation en libérant l'énergie élastique stockée lorsqu'ils se redressent sous des fluctuations thermiques, conformément au mécanisme élastique à cliquet brownien pour la production de force médiée par l'actine (Actin Mechanics and Fragmentation 2015).
- Une partie de l'énergie élastique des filaments courbés est libérée à mesure que l'internalisation augmente, suggérant une compression réversible du réseau pour stocker l'énergie élastique.
- Toutefois, une fraction importante de la flexion du filament est conservée après le relâchement du ressort, ce qui suggère que la charge modifie également la structure intrinsèque du réseau (Force Feedback Controls Motor Activity and Mechanical Properties of Self-Assembling Branched Actin Networks 2016).
2. Dans les géométries plates, les réseaux d'actine ramifiés s'adaptent à la charge (Load Adaptation of Lamellipodial Actin Networks 2017).
Dans l'endocytose, la distribution des Hip1R autour du puits dirige davantage de filaments vers la base du puits, ce qui nuclée plus de filaments de manière autocatalytique et augmente la flexion des filaments, favorisant ainsi une plus grande internalisation.

Les réseaux de microfilaments d'actine et les ABP (Actin Binding Protein) provoquent, par leur croissance, l'invagination des vésicules d'endocytose, leur intériorisation et leur transport dans la cellule.
5. Détachement de la membrane : fission
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseCavéolesVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


