Trafic vésiculaire :
Endocytose clathrine-indépendante (CIE)
Cavéoles
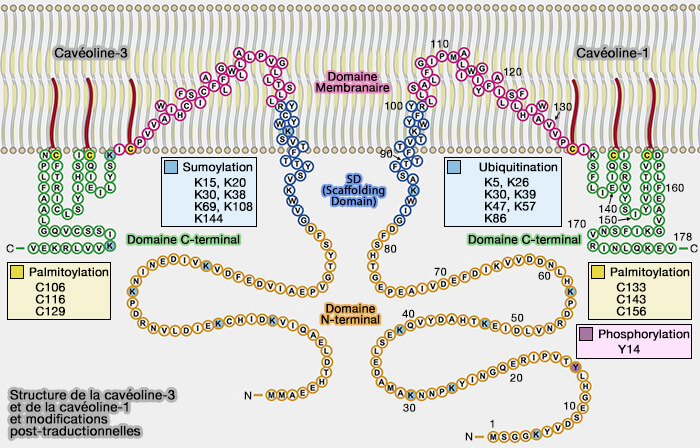
Cavéolines : modifications post-traductionnelles
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les cavéolines peuvent subir différentes modifications post-traductionnelles pour favoriser l'endocytose des cavéoles et leur dégradation.
(Figure : vetopsy.fr d'après Busija et coll)
Nous envisagerons essentiellement quelques modifications post-traductionnelles de Cav1, Cav3 étant sumoylée et jamais phosphorylée (Caveolins and cavins in the trafficking, maturation, and degradation of caveolae: implications for cell physiology 2016).
Phosphorylation

La face cytoplasmique de Cav1 contient un site de phosphorylation, i.e. Y14 (Tyr14), pY14, qui contrôle l'internalisation des protéines membranaires indépendantes de la clathrine et de l'endocytose des cargos macromoléculaires.
Vue d'ensemble
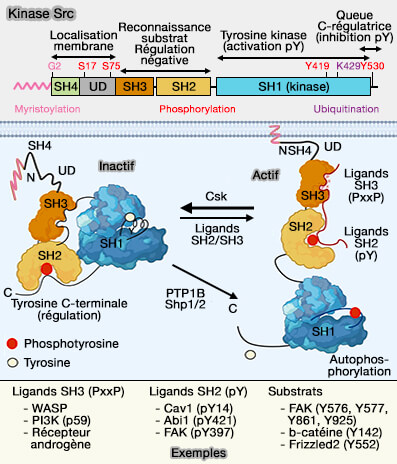
La phosphorylation de Cav1 a d'abord été trouvée par l'action de Src (Proto-oncogene tyrosine-protein kinase Src), puis sur d'autres kinases comme FYN (Proto-oncogene tyrosine-protein kinase Fyn ou p59-FYNo) ou ABL.
(Figure : vetopsy.fr d'après Ortiz et coll)
1. Cette phosphorylation nécessite la palmitoylation de C156, ce qui suggère qu'elle a lieu au niveau de la membrane cytoplasmique (Palmitoylation of caveolin-1 at a single site (Cys-156) controls its coupling to the c-Src tyrosine kinase: targeting of dually acylated molecules (GPI-linked, transmembrane, or cytoplasmic) to caveolae effectively uncouples c-SRC et caveolin-1 (Tyr-14) 2001).
- En outre, il faut le motif myristoyl plus basique de Src (Cooperative Role of Caveolin-1 and C-Terminal Src Kinase Binding Protein in C-Terminal Src Kinase-Mediated Negative Regulation of c-Src 2011).
- pY14 se lie au domaine SH2 de Src, échafaudant ainsi cette kinase plus étroitement à Cav1 après l'activation de Src (Src-mediated caveolin-1 phosphorylation affects the targeting of active Src to specific membrane sites 2013).
2. Y14 phosphorylée régule la durée de l'activité de Src en se liant :
- soit à la tyrosine kinase c-Src (Csk) pour inhiber la Src via la phosphorylation de Y530,
- soit à la tyrosine phosphatase 2 (SHP-2) qui interfère avec la liaison Y14 phosphorylée et Csk, ce qui pourrait contrôler l'endocytose des cavéoles médiée par Src (SHP-2 Binds to Caveolin-1 and Regulates Src Activity via Competitive Inhibition of CSK in Response to H2O2 in Astrocytes 2014).
3. La phosphorylation de Y14 déstabilise les oligomères 70S-Cav par un changement conformationnel qui sépare spatialement ou déverrouille les molécules Cav1 au sein du manteau cavéolaire, provoquant leur dissociation (Src-dependent phosphorylation of caveolin-1 Tyr-14 promotes swelling and release of caveolae 2016).
-
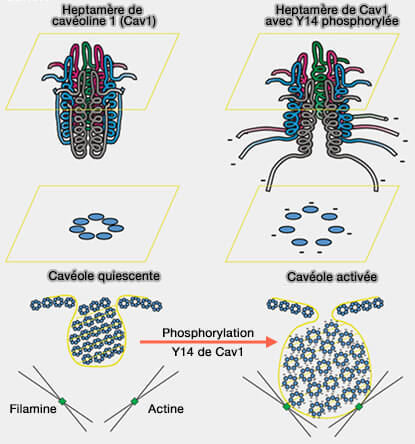
Conséquence globale de la phosphorylation de Y14
(Figure : vetopsy.fr d'après Zimnicka et coll) - Le blocage de la phosphorylation de Y14 stabilise les grands oligomères.
Phosphorylation et
cytosquelette
Phosphorylation
de Cav1
et endocytose
cavéolaire
La phosphorylation de Cav1 et la signalisation Src initient l'endocytose en provoquant le gonflement (swelling), suivi de la libération des cavéoles dans le cytoplasme (
1. La signalisation Src provoque la phosphorylation de la dynamine-2 qui détache les cavéoles de la membrane (Src-mediated Tyrosine Phosphorylation of Dynamin Is Required for β2-Adrenergic Receptor Internalization and Mitogen-activated Protein Kinase Signaling 1999).
Remarque : la phosphorylation de Cav1 pourrait provoquer
la perte d'EHD2, qui conduit aussi à la scission des cavéoles, vraisemblablement par hydrolyse de l'ATP qui désassemble les oligomères d'EDH2, ce qui permet le recrutement de la dynamine (
La dynamine recrute l'actine et la cortactine, le régulateur d'actine (A Dynamin–Cortactin–Arp2/3 Complex Mediates Actin Reorganization in Growth Factor-stimulated Cells
2003 et 

La dynamine et ses partenaires de fission sont étudiés dans des chapitres spéciaux.
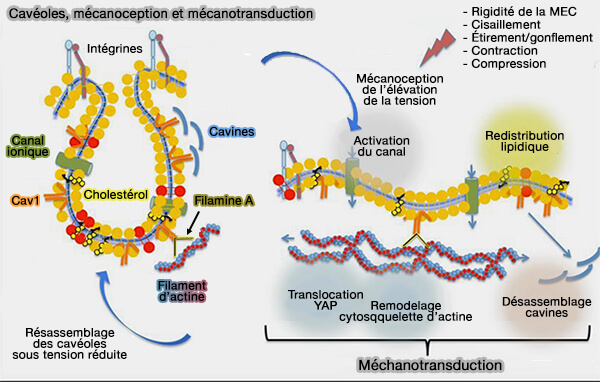
2. En outre, Y14p se lie à l'extrémité C-terminale de la filamine A (FLNa) qui fait partie des protéines de réticulation (actin cross-linking proteins) qui comprennent deux sites de liaison à l'actine, i.e. interconnectent les microfilaments d'actine en de nombreuses conformations (Filamin A Regulates Caveolae Internalization and Trafficking in Endothelial Cells 2009).
(Figure : vetopsy.fr d'après Lolo et coll)
a. Le lien entre les cavéoles et le cytosquelette d'actine par la filamine assure la stabilité au sein de la membrane plasmique et limite le mouvement latéral des cavéoles (Tumor-stroma biomechanical crosstalk: a perspective on the role of caveolin-1 in tumor progression 2020).
- L'appauvrissement en FLNa entraîne un mouvement incontrôlé et non linéaire des cavéoles dans la membrane plasmique (Phosphorylated filamin A regulates actin-linked caveolae dynamics 2011).
- Cela suggère que l'attachement au cytosquelette d'actine pourrait influencer le confinement de la surface cellulaire des cavéoles.
En plus de s'associer à l'actine et à Cav1, la filamine A se lie également à plusieurs autres protéines, l'une étant PKCα, qui peut phosphoryler la syndapine 2/PACSINe 2 pour la libérer de la membrane plasmique (
b. La filamine A intervient dans la mécanotransduction pour remodeler le cytosquelette d'actine (
3. Le cholestérol induirait une courbure plus élevée de la membrane cavéolaire (Lipid accumulation controls the balance between surface connection and scission of caveolae 2020).
Le cholestérol seul augmente la scission des cavéoles de la membrane plasmique, scission inhibée par EHD2 qui se lie et stabilise le cou. Dans ce modèle, les lipides entraînent la formation/scission de la cavéole par régulation des interactions membranaires de Cav1.
- L'épuisement du cholestérol entraîne l'aplatissement des cavéoles et la dissociation des cavines dans le cytoplasme (Cholesterol Depletion in Adipocytes Causes Caveolae Collapse Concomitant with Proteosomal Degradation of Cavin-2 in a Switch-Like Fashion 2012).
- La liaison de la syndapine 2/PACSINe 2 à la membrane peut être régulée négativement par le cholestérol (
syndapine 2 et cholestérol).
Phosphorylation de Cav1 et migration cellulaire
Cav1 contrôle la stabilité des adhérences focales, l'organisation de l'actine et la contraction de l'actomyosine par le biais des RHO GTPases (Biomechanical Remodeling of the Microenvironment by Stromal Caveolin-1 Favors Tumor Invasion and Metastasis 2011).
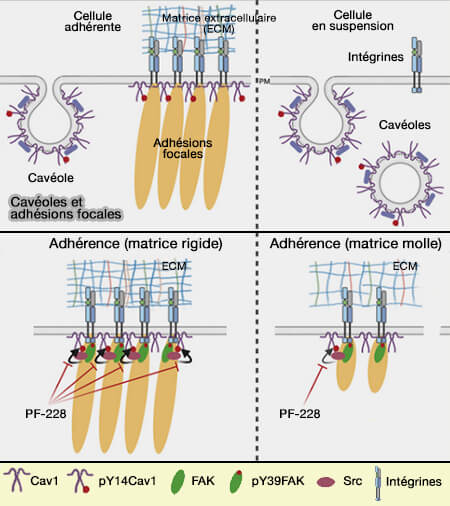
(Figure : vetopsy.fr d'après Buwa et coll)
Dans les adhésions focales, Y14p se lie à la vinculine (Phospho-Caveolin-1 Mediates Integrin-Regulated Membrane Domain Internalisation 2015 et Adhesion-dependent Caveolin-1 Tyrosine-14 phosphorylation is regulated by FAK in response to changing matrix stiffness 2020).
1. L'interaction entre les assemblages d'actine cytoplasmique et la Cav1 phosphorylée coordonne la migration cellulaire (Feedback-Driven Mechanisms Between Phosphorylated Caveolin-1 and Contractile Actin Assemblies Instruct Persistent Cell Migration 2021).
- Les Cav1 cellulaires affichent une motilité associée à l'actine en glissant le long ou/et en subissant un flux rétrograde avec des microfilaments d'actine.
- Une contractilité adéquate des filaments d'actine est essentielle pour la phosphorylation de Cav1 sur son site critique Tyr14, ainsi que pour la distribution et la motilité ultérieures des vésicules intracellulaires de Cav1.
Les vésicules cytoplasmiques de Cav1 non seulement se déplacent le long des filaments d'actine, mais accompagnent également des arcs transversaux d'actomyosine pour un écoulement centripète, ce qui nécessite une contraction de la myosine.
2. La déplétion de Cav1 et la phosphorylation de Cav1 sur Tyr14 sont capables d'affecter les niveaux actifs d'AMPK et de RhoA/Rac1 GTPase en régulant la localisation de p190RhoGAP, un inhibiteur endogène de Rho (Caveolin-1 regulates cell polarization and directional migration through Src kinase and Rho GTPases 2007).
- Les cellules dépourvues de cavéoline-1 perdent leur sens de migration cellulaire directionnelle et présentent un cytosquelette d'actine déformé.
- Tous ces bouleversements dans les structures contractiles et protrusives de l'actine cytoplasmique provoquent des changements significatifs dans la morphologie de la cellule et la migration directionnelle (Caveolin-1 Modulates Mechanotransduction Responses to Substrate Stiffness through Actin-Dependent Control of YAP 2018).
Ubiquitination
La face cytoplasmique de Cav1 renferme des sites d'ubiquitination (Ubiquitination of the N-terminal Region of Caveolin-1 Regulates Endosomal Sorting by the VCP/p97 AAA-ATPase 2013).
- Une expression élevée de cavéoline peut être nocive et les cellules ont des mécanismes complexes évolués pour éviter les effets toxiques des cavéolines mal localisées, en particulier dans la voie de sécrétion précoce, i.e. au niveau de l'appareil de Golgi (Overexpression of Caveolin-1 Is Sufficient to Phenocopy the Behavior of a Disease-Associated Mutant 2013).
- Cette voie est perturbée par de nombreuses mutations, en particulier dans les dystrophies musculaires (Caveolinopathies: from the biology of caveolin-3 to human diseases 2009).
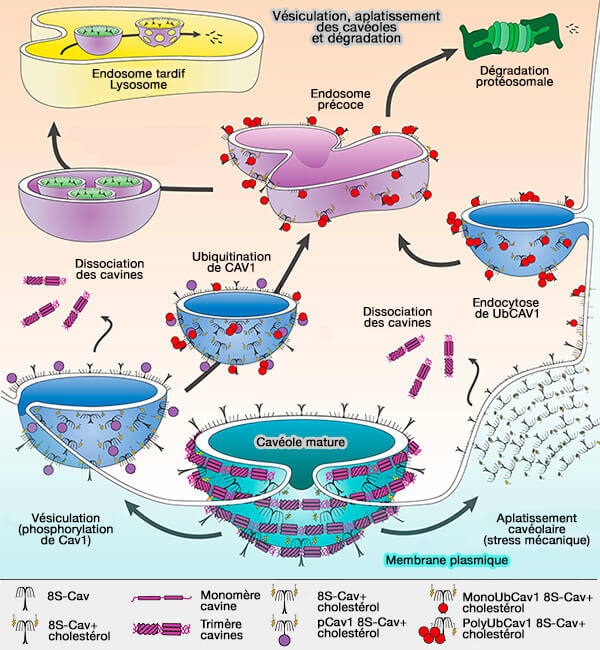
(Figure : vetopsy.fr d'après Busija et coll)
1. Lors de la dissociation des cavines de la cavéole, les Cav sont monoubiquitinées sur les lysines K5, K26, K30, K39, K47, K57 et polyubiquitinées sur K86., puis sont endocytées.
2. Les mono- et poly-UbCav1 sont dirigées vers les endosomes pour subir :
- soit une dégradation lysosomale (Caveolin-1 is ubiquitinated and targeted to intralumenal vesicles in endolysosomes for degradation 2010).
- soit pour un traitement protéosomal (Nitrosation-dependent caveolin 1 phosphorylation, ubiquitination and degradation and its association with idiopathic pulmonaryarterial hypertension 2013).
Dans les cancers de la prostate, Cav1 peut être sécrétée dans une nouvelle classe d'exosomes d'environ 40 nm de diamètre contenant environ 50 à 60 copies de Cav1 qui sont libérées via une macroautophagie sécrétoire non canonique (An inverted CAV1 (caveolin 1) topology defines novel autophagy-dependent exosome secretion from prostate cancer cells 2020).
(Figure : vetopsy.fr d'après Busija et coll)
Remarque : Cav3 est sumoylée à peu près aux mêmes sites que ceux de l'ubiquitination de Cav1 (Caveolin-3 undergoes SUMOylation by the SUMO E3 ligase PIASy: sumoylation affects G-protein-coupled receptor desensitization 2011).
Palmitoylation

Pour plus de détails sur la palmitoylation de Cav1, vous pouvez lire : Palmitoylation of Caveolin-1 and its importance for structural and functional plasticity (2018).
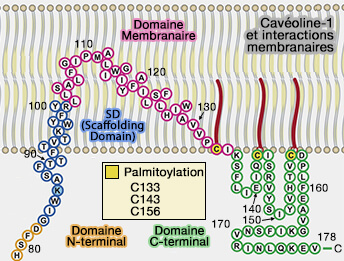
1. Sur la surface faisant face à la membrane, on trouve les sites de palmitoylation sur les cystéines de l'extrémité C-terminale des Cav, i.e. C133, C143 et C156 dans Cav1 (Palmitoylation of caveolin-1 is regulated by the same DHHC acyltransferases that modify steroid hormone receptors 2018).
La palmitoylation n'est pas essentielle pour la localisation membranaire des Cavs, mais stabilise pendant 24 heures les cavéoles dans les cellules endothéliales (Caveolin Is Palmitoylated on Multiple Cysteine Residues: palmitoylation is not necessary for localisation of caveolin to caveolae 1995).
-
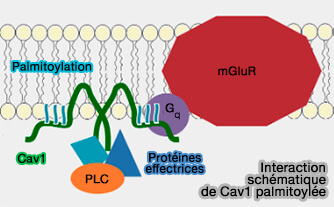
Cav1 palmitoylée et interactions
(Figure : vetopsy.fr d'après Tonn et coll) - Elle permettrait peut être de renforcer l'attache membranaire du domaine IM ou de conforter l'attache des cavéoles par l'intermédiaire des cavines.
La phosphorylation de Y14 par Src nécessite la palmitoylation de C156 (
2. Cav1 palmitoylée interagit avec les protéines de signalisation à la membrane plasmique.
3. Les cavéoles protègent les cavéolines de l'ubiquitination et de la dépalmitoylation (Biogenesis of Caveolae: Stepwise Assembly of Large Caveolin and Cavin Complexes 2010).
Composition des cavéoles : cavines
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


