Trafic vésiculaire :
Endocytose clathrine-indépendante (CIE)
Cavéoles
Désassemblage
des cavéoles
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires : trafic vésiculaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Le désassemblage des cavéoles peut intervenir par la perturbation de la stabilité des cavéoles, i.e. stress mécanique ou oxydatif, UV, activité endocytaire ou voies de transduction du signal.
Désassemblage des cavéoles
1. La biogenèse des cavéoles a montré que l'assemblage dépend étroitement de l'association des cavéolines (Cav) et des cavines.
Les cavéoles protègent les Cav :
- de la dégradation en empêchant le mouvement latéral et l'échange des Cavs et des cavines, grâce à EHD2 et aux syndapines/PACSINes,
- de l'ubiquitination et de la dépalmitoylation.

Toute perturbation de cette stabilité, i.e. stress mécanique, activité endocytaire ou voies de transduction du signal, libère les cavines des cavéoles et conduit à de nombreuses voies d'endocytose des Cavs (Cells Respond to Mechanical Stress by Rapid Disassembly of Caveolae 2011).
L'aplatissement des cavéoles ne veut pas forcément dire désassemblage, bien que certaines protéines peuvent se dissocier du complexe cavéolaire comme EHD2.
Par contre, le désassemblage peut suivre l'aplatissement.
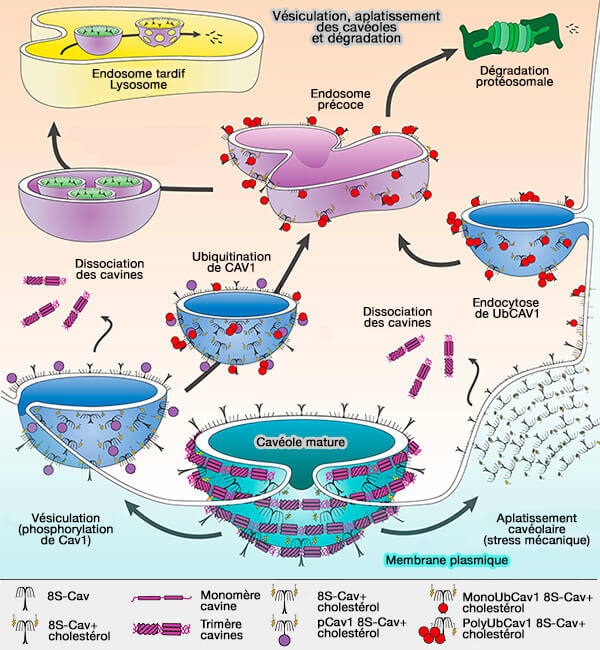
(Figure : vetopsy.fr d'après Busija et coll)
2. Le désassemblage des cavéoles et la dissociation des 70S-Cav impliquent des modifications post-traductionnelles dynamiques des Cav.
a. Le désassemblage pourrait commencer par la phosphorylation de Y14 de Cav1 par les kinases, en particulier Src qui nécessitent la palmitoylation de C156 et le motif myristoyl plus basique de Src (
Cette phosphorylation conduit :
- à l'endocytose par l'action de la dynamine et l'interaction avec le cytosquelette (
détachement des cavéoles),
- à la dissociation des 70S-Cav.
Puis les Cav sont alors ubiquitinées avant de rejoindre les endosomes précoces pour suivre le voie classique, i.e. endosomes tardifs/lysosomes pour la dégradation lysosomale, ou alors le traitement protéosomal (
b. Le désassemblage pourrait aussi commencer par l'aplatissement des cavéoles, indépendant de l'ATP et de l'actine, et la dissociation des 60S-cavines suite à un stress mécanique.
- Les cavines peuvent être libérées sous forme de trimères cavine 1/cavine 1, cavine 1/cavine 2, cavine 1/cavine 3 (Single-molecule analysis reveals self assembly and nanoscale segregation of two distinct cavin subcomplexes on caveolae 2014 et Identification of intracellular cavin target proteins reveals cavin-PP1alpha interactions regulate apoptosis 2019).
- Comme la cavine s'associe aux lipides des cavéoles, le désassemblage n'affecterait pas directement la localisation de la 70S-Cav à la membrane plasmique (MP).
Les cavines peuvent alors être recyclées ou ubiquitinées, car le site est masqué lors de l'attache membranaire, pour dégradation dépendante du protéosome (
Remarque : certains pensent que la phosphorylation de la cavine 1 pourrait être suffisante pour déclencher la dissociation des cavéoles. L'appauvrissement en cholestérol avec l'U18666A qui inhibe le trafic de cholestérol dans les cellules entraîne également la dissociation de la 60S-cavine de la MP.
Conséquences du désassemblage
Le désassemblage ou les modifications des cavéoles provoquent des effets multiples lors de :
- la libération des cavines,
- la libération des cavéolines,
- les modifications de la composition lipidique de la membrane.
Libération des cavines
1. Les cavines peuvent potentiellement interagir avec les protéines intracellulaires et les réguler, i.e. 47 décrites dans l'article ci-dessous.
Ces interactions sont certainement possibles par la libération des différents trimères avec, de plus, leur régulation par différentes phosphorylations.
2. Par exemple, la cavine 3 libérée interagit alors directement par son domaine HR2 avec la phosphatase PP1alpha (Identification of intracellular cavin target proteins reveals cavin- PP1alpha interactions regulate apoptosis 2019).
- La cavine 3 inhibe son activité catalytique et augmente ainsi la phosphorylation de H2AX, un ADN clé indicateur de dommage, déclenchant l'apoptose.
- Dans ce cas, les cavéoles enclenchent le suicide cellulaire et empêchent la survie des cellules abritant des dommages délétères de l'ADN.
La perte d'expression de cavine 3 par la méthylation de son promoteur est étroitement liée à la progression du cancer.
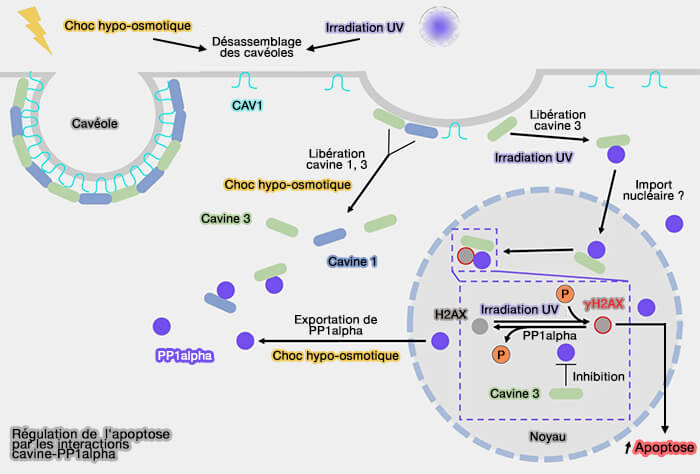
(Figure : vetopsy.fr d'après McMahon et coll)
2. Dans les adipocytes, l'insuline stimule la phosphorylation de la cavine 1 sur Tyr158, ce qui provoque sa libération des cavéoles pour subir une translocation vers le noyau (PTRF/Cavin-1 promotes efficient ribosomal RNA transcription in response to metabolic challenges 2016).
- Elle augmente la transcription ribosomique d'ADN pour stimuler la biosynthèse indispensable, en particulier GLUT4 au cavéoles.
3. Les cavines peuvent aussi intervenir dans :
- dans la régulation du rythme circadien, par l'interaction avec PER2 (PERiod 2) et CRY2 (CRYptochrome 2) (CAVIN-3 regulates circadian period length and PER:CRY protein abundance and interactions 2012),
- le facteur de transcription p53, dit gardien du génome,
- des protéines ribosomiques de liaison à l'ARN telles que DDX21, ELAVL1 ou Mybbp1a.
Libération des cavéolines
1. La phosphorylation de Tyr14 de CAV1, générée en réponse à des facteurs de croissance ou à des stimuli de stress, peut recruter des protéines spécifiques, comme :
- TRAF2 (TNF Receptor-Associated Factor 2), la protéine adaptatrice lors de stress oxydatif au niveau des endosomes précoces (Cell-free formation and interactome analysis of caveolae 2018),
- EGR1 (Early Growth Response-1), facteur de transcription pour lever son inhibition sur les promoteurs de transcription des protéines cavéolaires (Phosphocaveolin-1 is a mechanotransducer that induces caveola biogenesis via Egr1 transcriptional regulation 2012).
2. Les cavéolines seules peuvent intervenir dans de nombreux processus (
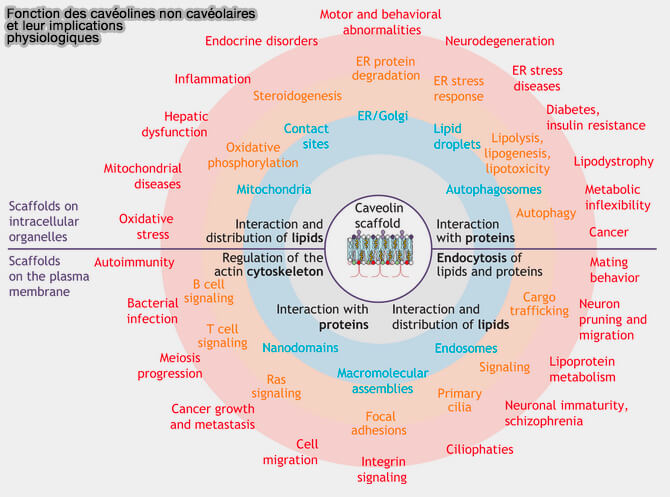
(Figure : vetopsy.fr d'après Pol et coll)
Réorganisation des lipides membranaires
Le désassemblage cavéolaire provoque une réorganisation des lipides membranaires qui a un impact sur la signalisation (Caveolae regulate the nanoscale organization of the plasma membrane to remotely control Ras signaling 2014).

Les associations protéine-lipide, i.e. via des domaines transmembranaires, des sites d'interaction avec la membrane et/ou des modifications post-traductionnelles d'acides gras, des interactions lipide-lipide peuvent stabiliser et concentrer les partenaires de liaison pour leur régulation (Membrane proteins bind lipids selectively to modulate their structure and function 2014).
Le cholestérol membranaire et d'autres lipides dans les cavéoles peuvent influencer :
-
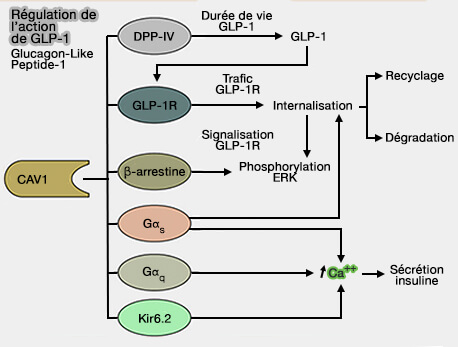
Régulation de GLP-1
(Figure : vetopsy.fr d'après Puddu et coll) - les interactions protéine-protéine,
- la transduction du signal, par exemple, par la plasticité conformationnelle du β2AR ou l'affinité et l'activation des protéines G (Allosteric regulation of G protein–coupled receptor activity by phospholipids 2016 et Cholesterol-dependent Conformational Plasticity in GPCR Dimers 2016).
Par exemple, les récepteurs couplés aux protéines G (GPCR) peuvent être recrutés dans les cavéoles :
- par interaction directe avec la cavéoline par le motif classique de liaison à la cavéoline-1, ΦxΦxxxxΦ, ΦxxxxΦxxΦ, et ΦxΦxxxxΦxxΦ dans lequel Φ est un résidu aromatique et x tout autre résidu, ici EGVYLYTLLAFSVF,
- via une interaction médiée par Gαq avec la cavéoline (Arrestin-Dependent and -Independent Internalization of G Protein–Coupled Receptors: Methods, Mechanisms, and Implications on Cell Signaling 2021 et Emerging Role of Caveolin-1 in GLP-1 Action 2021).
Retour vers les cavéoles
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


