Transport des lipides
Transporteur ABC : ABCA1
Formation des HDL (lipoprotéines de haute densité)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le transporteur ABCA1 a un rôle essentiel dans la formation des préβ-HDL, HDL (lipoprotéines de haute densité) naissantes.
(Figure : vetopsy.fr)
Vue d'ensemble de la formation des HDL
1. Dans la formation des préβ-HDL, mais aussi dans la première étape de la voie RCT (transport inverse du cholestérol), ABCA1 exporte l'excès de cholestérol libre cellulaire et de phosphatidylcholine (PC) vers l'apoA-I sans lipides circulants (Function and regulation of ABCA1 – membrane meso-domain organization and reorganization (2011).).
Cela génère une HDL naissante, un fragment bicouche formé de 200 à 700 lipides enveloppés par deux à quatre molécules d'apoA-I (Characterization of nascent HDL particles and microparticles formed by ABCA1-mediated efflux of cellular lipids to apoA-I 2006 et Nascent high density lipoproteins formed by ABCA1 resemble lipid rafts and are structurally organized by three apoA-I monomers 2011).
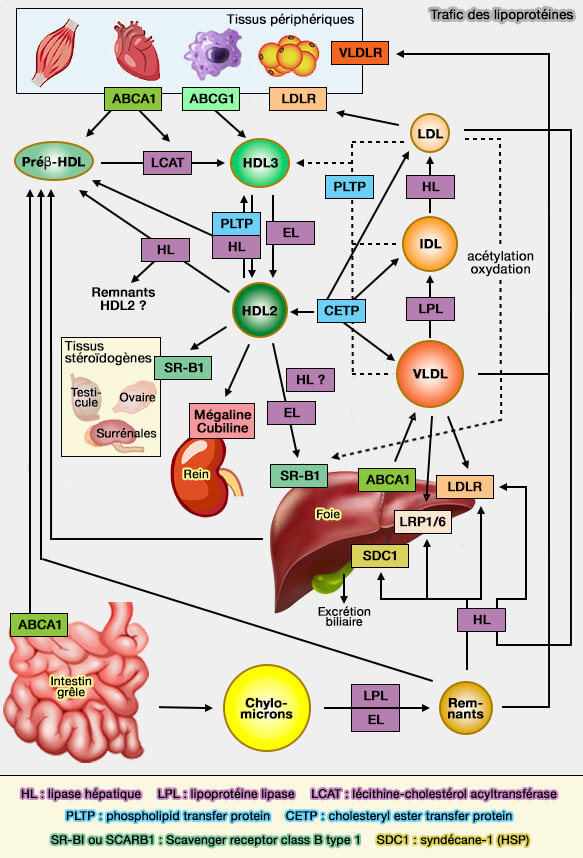
2. Le modèle hypothétique de l'adaptation des apoA-I à la formation et au remodelage des HDL est décrit dans le chapitre sur l'apoA-I, modèle qui prédit que le nombre d'apoA-I évolue avec la taille des HDL naissants.
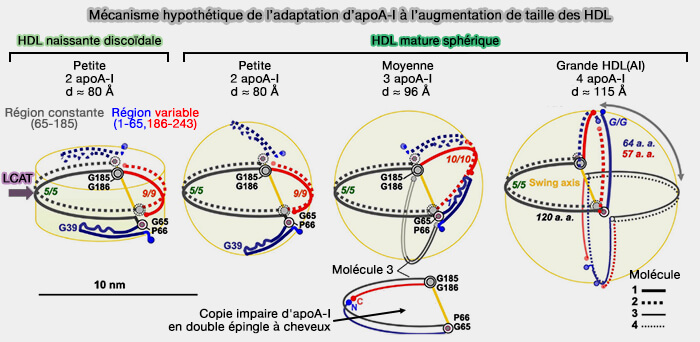
(Figure : vetopsy.fr d'après Gursky)
Modèles possibles de biogenèse des préβ-HDL
Il ne peut y avoir de consensus qui puisse concilier les différences entre les neuf modèles de biogenèse HDL (Molecular mechanisms for ABCA1-mediated cholesterol efflux 2022).
1. Toutefois, deux points semblent acquis.
- ABCA1 transloque à la fois les phospholipides (PL) et le cholestérol des membranes plasmiques vers le domaine extracellulaire (ECD1) d'ABCA1 (Unraveling the complexities of the HDL lipidome 2013).
- Les extrémités C-terminales et N-terminales de l'apoA-I sont essentielles à la formation des HDL.
2. Deux grandes catégories de modèles ont été proposés pour expliquer comment se forment les particules HDL-C naissantes.
a. Selon le modèle de chargement dit direct, ABCA1 transfère directement les lipides à l'apoA-I pendant qu'elle est liée au transporteur.
b. Dans le modèle dit indirect, l'activité de translocation des phospholipides (PL) de la protéine ABCA1 forme des domaines membranaires spécifiques et l'ApoA-I acquiert des lipides à travers ces domaines.
Modèles directs
Dans ces modèles, l'apoA-I et ABCA1 entreraient directement en interaction (
Vue d'ensemble
ABCA1 possèderait un site spécifique sur ECD1 pour la liaison avec l'apoA-I (Apolipoprotein A-I directly interacts with extracellular domain 1 of human ABCA1 2019).
La conformation dépendante de l'hydrolyse de l'ATP changerait la conformation de l'ECD1 pour cette liaison et une séquestration des lipides dans la cavité.
Mécanisme
Un modèle du mécanisme de biogenèse des HDL serait le suivant (N-terminal mutation of apoA-I and interaction with ABCA1 reveal mechanisms of nascent HDL biogenesis 2019).

(Figure : vetopsy.fr d'après Liu et coll)
1. Sans apoA-I, ABCA1, par son activité basale, transloque le cholestérol et d'autres lipides entre les feuillets membranaires, créant des structures en forme de renflement sur la membrane et/ou libérant des particules sans apoA-I.
2. Dans la voie dépendante de l'apoA-I, l'apoA-I ;
- s'amarre à la membrane cellulaire par son extrémité C hydrophobe qui a été réarrangée par ABCA1,
- interagit par son extrémité N-terminale à ABCA1.
Son faisceau N-terminal s'ouvre et permet à l'apoA-I de se dimériser.
3. L'apoA-I dimérisée recrute les phospholipides (PL) et le cholestérol transportés par ABCA1 et forme de petites particules de préβ-HDL.
4. Les petites particules de préβ-HDL engrangent plus de lipides à partir de particules sans apoA-I produites dans la voie indépendante de l'apoA-I ou à partir de renflements membranaires par diffusion passive pour former de plus grandes préβ-HDL.
Modèles indirects
Des arguments plaident pour le(s) modèle(s) indirect(s).
Vue d'ensemble
1. Les interactions ABCA1-apoA-I ne représentent qu'environ 10% de la liaison de l'apoA-I aux cellules, alors que les interactions lipide-apoA-I dans un microdomaine PM créé par ABCA1 représentent la majeure partie de l'apoA-I (ABCA1-Induced Cell Surface Binding Sites for ApoA-I 2007).
Deux types de sites de liaison à l'apoA-I sont retrouvés sur les membranes plasmiques des cellules exprimant ABCA1 (Identification of an ABCA1-dependent phospholipid-rich plasma membrane apolipoprotein A-I binding site for nascent HDL formation: implications for current models of HDL biogenesis 2007) :
- un site de liaison de haute affinité/faible capacité, formé par l'interaction directe apoA-I/ABCA1 qui jouerait un rôle régulateur,
- un site de liaison de faible affinité/haute capacité (HCBS), i.e. capacité 9 fois supérieure à lier l'apoA-I par rapport au site ABCA1 classique, qui serait utilisé dans l'assemblage des particules HDL naissantes.
2. L'activité PL-translocase d'ABCA1 augmente les densités des phospholipides (PL) dans le feuillet externe, mettant ainsi la pression sur le feuillet pour créer un microdomaine de membrane plasmique exovésiculé (Surface Density-Induced Pleating of a Lipid Monolayer Drives Nascent High-Density Lipoprotein Assembly 2015).

Vous pouvez trouver une structure détaillée d'ABCA1 dans : ABCA1 is an extracellular phospholipid translocase (2022).

(Figure : vetopsy.fr d'après Segrest et coll)
3. Les hélices α amphipathiques de l'apoA-I ont des propriétés intrinsèques de liaison aux lipides et se lient au microdomaine de la membrane plasmique (Is ABCA1 a lipid transfer protein? 2018).
4. Le traitement à la trypsine provoque une libération rapide de phosphatidylcholine (PC) et de cholestérol à partir des cellules BHK/ABCA1, i.e. BHK, baby hamster kidney (Temporary sequestration of cholesterol and phosphatidylcholine within extracellular domains of ABCA1 during nascent HDL generation 2018).
- L'évolution temporelle de la libération des lipides coïncide avec celle de la digestion par la trypsine des domaines extracellulaires (ECD) de la surface ABCA1 et de libération de fragments d'ECD dans le milieu.
- Cette libération de lipides dépendant de la trypsine dépend de l'activité ATPase de ABCA1 , et non avec les cellules qui expriment ABCG1, qui exporte des lipides comme ABCA1 mais n'a pas de grands ECD.
Mécanismes possibles
Mécanisme 1
Le mécanisme pourrait être le suivant.
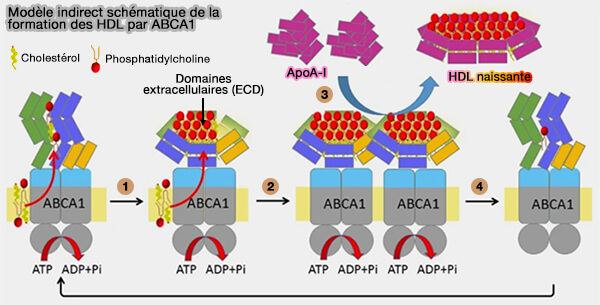
(Figure : vetopsy.fr d'après Ishigami et coll)
1. Les monomères ABCA1 transloquent la phosphatidylcholine (PC) et le cholestérol de manière dépendante de l'ATP et les séquestrent dans les domaines extracellulaires (ECD).
2. Lorsque suffisamment de PC et de cholestérol ont été séquestrés par les ECD, les ECD subissent des changements conformationnels qui conduisent à la formation de dimères et à l'arrêt de leur mouvement de diffusion.
3. Les molécules d'apoA-I sans lipides peuvent se lier directement aux ECD des dimères ABCA1 et se charger de lipides séquestrés dans les ECD.
4. La préβ-HDL est générée et le dimère ABCA1 se dissocie en monomères lors de la libération des lipides séquestrés, revenant ainsi à l'étape 1.
Mécanisme 2
Toutefois, les structures ABCA1 montrent que l'ECD forme un tunnel étroit et allongé d'environ 60 Å, suggérant que l'ECD pourrait fonctionner comme un passage pour le transport des lipides plutôt que comme un large réservoir de lipides.
1. Un microdomaine riche en cholestérol qui contient des protéines desmosomiques, i.e. en particulier la desmocolline 1 (DSC1) qui est une protéine dont les domaines ECIV-V (Extracellular Cadherin Repeats se lie à l'apoA-I, a été découvert récemment (Desmocollin 1 is abundantly expressed in atherosclerosis and impairs high-density lipoprotein biogenesis 2017).

(Figure : vetopsy.fr d'après Choi et coll)
2. Dans cet autre modèle, ABCA1, dans des cellules cellules chargées en cholestérol, transloque les phospholipides (PL) et le cholestérol à travers le tunnel hydrophobe jusqu'à la surface cellulaire (Biomedical Advances in ABCA1 Transporter: From Bench to Bedside 2023).
- Les lipides créent alors un microdomaine sur le feuillet externe de la membrane plasmique par des mécanismes inconnus.
- L'apoA-I enveloppe et solubilise le microdomaine pour produire des particules HDL naissantes, contrecarrée par la liaison de DSC1 qui peut ainsi empêcher le cholestérol d'être éliminé par la biogenèse des HDL.

Quels que soient les modèles, la fonction ABCA1 est la première étape cruciale pour la formation de HDL-C.
Retour à la biogenèse des HDL
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


