Système endomembranaire
Réticulum endoplasmique (RE)
Repliement des protéines et échec du repliement
- En construction

Le repliement des protéines garantit l’homéostasie cellulaire, et son échec expose des dégrons qui orientent les substrats vers les voies de qualité-contrôle.
Repliement des protéines
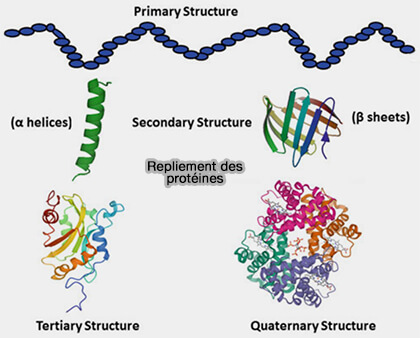
(Figure : vetopsy.fr d'après Chandra et coll)
Le repliement correct des protéines constitue un processus universel indispensable à l’homéostasie cellulaire (Understanding a protein fold: The physics, chemistry, and biology of α-helical coiled coils 2023).

Vous pouvez consulter : AlphaFold Protein Structure Database, un système IA pour prédire le repliement de 200 millions de protéines.
Parmi l’ensemble des compartiments, le réticulum endoplasmique (RE) occupe une position centrale car il assure la maturation de la majorité des protéines sécrétées et membranaires.
- La synthèse sur le réticulum endoplasmique rugueux oriente un grand nombre de polypeptides immatures vers sa lumière.
- À ce niveau, ils acquièrent leur structure tertiaire grâce à des modifications essentielles telles que la N-glycosylation, la formation de ponts disulfure, l’oligomérisation ou certaines phosphorylations… (The endoplasmic reticulum: structure, function and response to cellular signaling 2015).
Chaperonnes Hsp70 et protéines à domaine J
La maturation requiert la participation d’un ensemble spécifique de protéines chaperonnes dont GRP78 (Glucose Related Protein 78, appelée aussi BiP ou Binding Protein) qui appartient à la famille des Hsp70 (Heat Shock Protein 70).
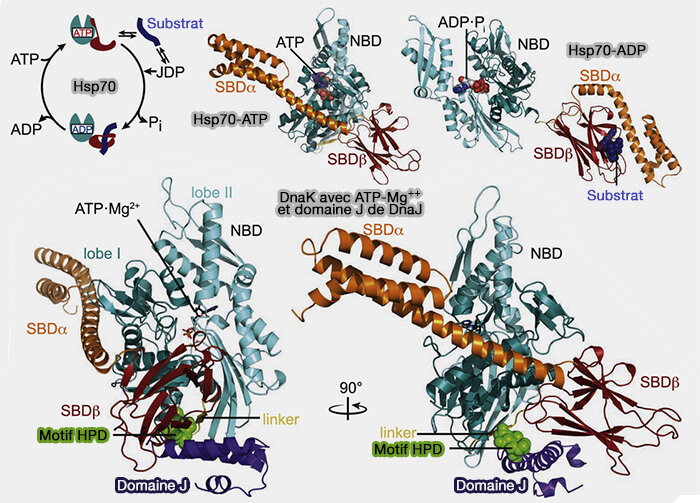
(Figure : vetopsy.fr d'après Kityk et coll)
1. Les Hsp70 font partie de la famille des protéines de choc thermique ou protéines de stress (HSP ou Heat-Shock Protein), i.e. protéines produites par les cellules en réponse à un stress (The human HSP70 family of chaperones: where do we stand? 2016 et The nucleotide exchange factors of Hsp70 molecular chaperones 2015) :
- en particulier, lors de leur découverte, à la dénaturation thermique, d'où leur nom,
- mais aussi au froid, aux UV ou pendant la cicatrisation des plaies ou le remodelage des tissus.
2. Les HSP70 fonctionnent en tandem avec des protéines adaptatrices appelées protéines à domaine J.

Les Hsp70, et, en particulier Hsc70, impliquée dans le déshabillage des vésicules de clathrine, sont étudiées dans un chapitre spécial.
Cycle canonique des Hsp70

(Figure : vetopsy.fr d'après Kampiga et coll)
1. Le mécanisme canonique des Hsp70 serait le suivant (Étude de l’expression du stress du réticulum endoplasmique au cours de l’inflammation systémique aiguë chez l’homme 2021).
- (1) Les protéines à domaine J se lient aux protéines clientes (non repliées).
- (2) Le complexe protéine J-cliente recrute la chaperonne HSP70.
- (3) L’hydrolyse de l’ATP entraîne un resserrement conformationnel de Hsp70 autour du substrat.
- (4) Le facteur d’échange nucléotidique (NEF) est recruté.
- (5) L’ADP est dissocié.
- (6) Une nouvelle molécule d’ATP se fixe.
- (7) Le complexe Hsp70–cliente–NEF se dissocie, laissant au substrat la possibilité d’adopter une conformation native.
2. Lorsque le repliement n’est pas atteint, un nouveau cycle est initié.
Et quand le repliement échoue ?
Vue d'ensemble
1. Dans les conditions physiologiques, le nombre de protéines chaperonnes du RE est supérieur à celui des protéines immatures afin d’éviter leur agrégation et de permettre une maturation satisfaisante.
a. Le maintien de cet équilibre est au cœur de la protéostasie, terme désignant l’ensemble des mécanismes cellulaires qui assurent la production correcte, le repliement, la surveillance qualité et, le cas échéant, l’élimination des protéines.
b. Dans le réticulum endoplasmique, cette homéostasie repose sur l’action coordonnée :
- des chaperonnes,
- de l’export des protéines mal conformées vers le cytosol via la filière ERAD,
- de leur dégradation protéasomale.
2. En cas d’échec répété du repliement, la protéine cliente est directement orientée vers la filière ERAD, qui assure sa rétro-translocation et son élimination.
Ce traitement individuel des substrats défaillants constitue la première ligne de défense contre l’accumulation de protéines immatures.
Distinction fonctionnelle et interactions entre ERAD et UPR
1. L’ERAD (Endoplasmic-Reticulum-Associated protein Degradation) représente une voie de contrôle qualité immédiate et procédurale, focalisée sur la gestion substrat par substrat des protéines mal repliées.
Elle élimine spécifiquement les polypeptides incapables d’acquérir leur conformation native, même après assistance des chaperonnes, préservant ainsi l’intégrité locale du réticulum endoplasmique.

L'ERAD (Endoplasmic-Reticulum-Associated protein Degradation) est étudiée dans un chapitre spécifique.
2. L'UPR (Unfolded Protein Response), en contraste, correspond à une réponse adaptative globale activée lorsque la charge en protéines immatures excède les capacités basales de repliement.
a. Dans le réticulum endoplasmique, l'UPR réorganise de manière coordonnée des programmes transcriptionnels et traductionnels visant :
- à augmenter la capacité de repliement,
- à renforcer l’ERAD,
- à moduler la dégradation et à réduire l’arrivée de nouvelles protéines dans le compartiment.
b. Cependant, des réponses UPR existent également dans d’autres organites, chacune fondée sur des capteurs, des chaperonnes et des voies de signalisation propres, notamment dans :
- les mitochondries,
- les gouttelettes lipidiques.

L'UPR (Unfolded Protein Response) est étudiée dans un chapitre spécifique.
c. L'UPR ne traite pas un substrat spécifique, mais elle réorganise l’ensemble du système pour restaurer un état stable d’homéostasie.
- L’activation de la réponse UPR ne procède pas d’un dégron individuel mais d’une accumulation globale de protéines immatures dans la lumière du RE.
- Lorsque les dégrons de repliement se multiplient au-delà de la capacité de prise en charge par les chaperonnes et la filière ERAD, la cellule active alors les senseurs de la UPR du RE pour rétablir l’homéostasie.

L’ERAD élimine les protéines défaillantes, tandis que l'UPR ajuste les ressources cellulaires pour éviter que leur accumulation ne devienne pathologique.
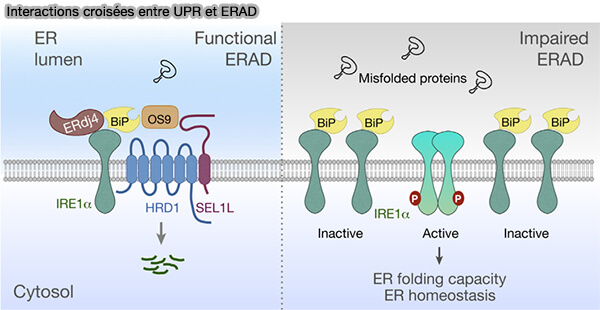
(Figure : vetopsy.fr d'après Hwang et Qi)
3. Pourtant, des interactions croisées entre ERAD et UPR assurent une coordination étroite entre les mécanismes d’adaptation et les voies de dégradation du réticulum endoplasmique (Quality Control in the Endoplasmic Reticulum: Crosstalk between ERAD and UPR pathways 2019).
a. L'UPR augmente l’expression des chaperonnes, des lectines et des composants ERAD, i.e. HRD1, SEL1L ou EDEM1, renforçant ainsi la capacité d’élimination des protéines défaillantes.
b. En retour, l’efficacité de l’ERAD détermine l’intensité et la durée de l’activation UPR.
- Une ERAD performante réduit la surcharge luminale et atténue les signaux de stress.
- Une ERAD saturée prolonge ou amplifie la réponse UPR.
c. Ce couplage fonctionnel maintient la protéostasie et prévient l’établissement d’un stress chronique du réticulum.
Retour au réticulum endoplasmique
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


