Domaines protéiques
Domaines
d'interaction membranaire
Domaine PX : liaisons

Le domaine PX (Phox homology) se lie aussi bien aux phosphoinositides qu'aux protéines pour cibler les membranes cellulaires, en particulier celles des organites du système endocytaire.
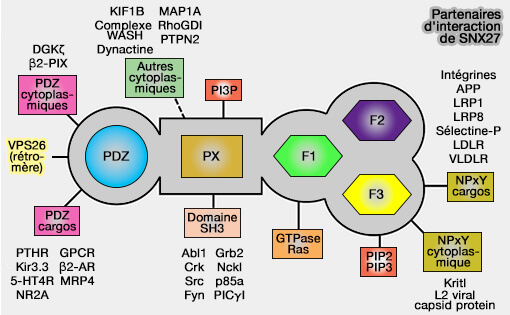
(Figure : vetopsy.fr d'après Chandra et coll)
Partenaires de liaison du domaine PX : phosphoinositides

Les membranes cellulaires eucaryotes contiennent des phosphoinositides (PI), éléments essentiels, qui diffèrent selon la membrane concernée (Phosphoinositides in Cell Architecture 2011 et Roles of Phosphoinositides and Their binding Proteins in Parasitic Protozoa 2019).
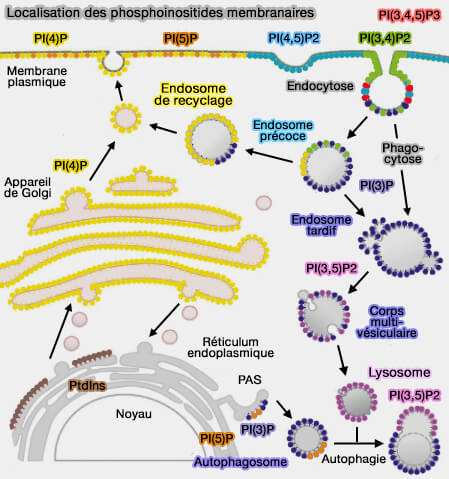
(Figure : vetopsy.fr d'après Cernikova et coll)
Les phosphoinositides sont :
- produits par mono-, bi- et triphosphorylation du groupe de tête inositol du phosphatidylinositol (PtdIns),
- concentrés dans des pools de membranes cytosoliques.
Les PI servent de marqueurs des compartiments cellulaires, i.e. un code phospholipide fournit une identité membranaire au sein du système endocytaire et forme des sites d'amarrage uniques pour les effecteurs des protéines (Translation of the phosphoinositide code by PI effectors 2010).
Vue d'ensemble
1. La plupart des domaines PX se lient au lipide canonique PI(3)P.
Ces interactions sont essentielles pour la localisation cellulaire de nombreuses protéines à domaine PX sur le feuillet externe des endosomes précoces, à forte proportion de PI(3)P (Insights into the PX (phox-homology) domain and SNX (sorting nexin) protein families: structures, functions and roles in disease 2012).
2. D'autres interagissent avec des phosphoinositides alternatifs :
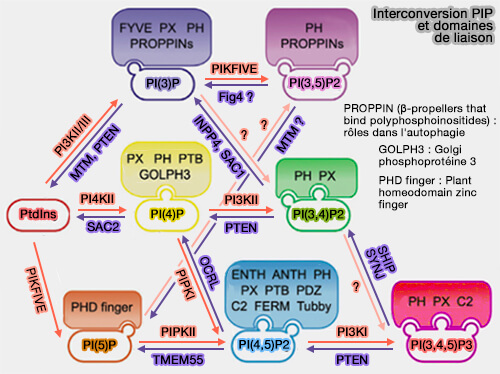
(Figure : vetopsy.fr d'après Cernikova et coll)
3. L'interaction du domaine PX avec des PI, plus ou moins présents dans les membranes, lui permet un certain tri des cargos lors de l'endocytose.
- Par exemple, les endosomes précoces sont riches en PI(3)P, cible privilégiée du domaine PX, mais pas la seule.
- Certaines nexines ne se lient pas aux lipides.
Sites de liaison
1. Le site de liaison canonique au PI(3)P est formé par une poche de liaison positive, impliquée dans la liaison directe avec les groupes phosphatés chargés négativement.
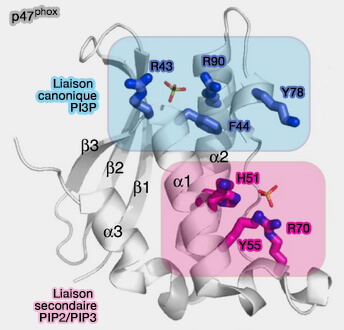
(Figure : vetopsy.fr d'après Chandra et coll)
Les chaînes latérales de 4 résidus essentiels (RYKR) sont requises pour cette interaction :
- l'arginine (R) et la tyrosine (Y) trouvées à la jonction entre β3 et α1, R se lie au 3-phosphate,
- la lysine (K) dans la séquence ΨPxxPxK dans la boucle PPK, Lys qui se lie au 1-phosphate,
- l'arginine (R) dans α2.
b. Toutes les protéines qui se lient à PI(3)P (groupes II et IV) possèdent ces quatre chaînes latérales essentielles, alors que pour les autres protéines (groupes I et III), au moins une des chaînes latérales clés fait défaut.

Pour plus d'explications sur les liaisons des groupes de protéines, voir l'information supplémentaire, i.e. figure S7, 8 et 9 de Classification of the human phox homology (PX) domains based on their phosphoinositide binding specificities (2019).
2. Certains domaines PX contiennent un site de liaison secondaire dit non canonique (groupe III et IV) dont le mécanisme exact n'est pas élucidé.
Il implique un patch de surface supplémentaire chargé positivement, centré sur une chaîne latérale histidine (H) ou tyrosine (Y) semi-conservée dans α1, associé à des chaînes latérales basiques de Lys (K) et d'Arg (R) basiques chargées positivement à l'extrémité C-terminale de l'hélice 1 ou au début de la boucle PPK.
Partenaires de liaison du domaine PX : protéines

Pour une revue des interactions avec les protéines, lire : Insights into the PX (phox-homology) domain and SNX (sorting nexin) protein families: structures, functions and roles in disease (2012).
1. Les protéines à domaine SH3 interagissent avec la boucle PPK (ΨPxxPxK) du domaine PX.
2. Les protéines du trafic vésiculaire se lient au domaine PX de certaines nexines comme, par exemple :
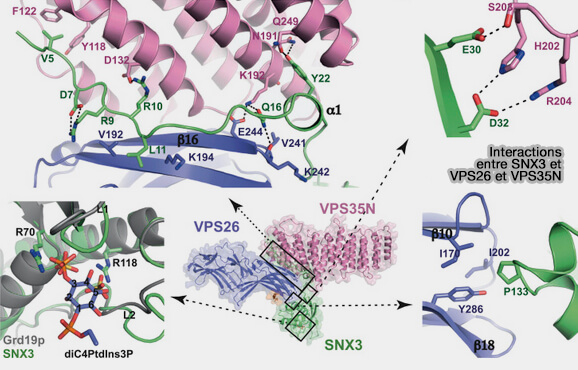
(Figure : vetopsy.fr d'après Lucas et coll)
- SNX5/6 et le rétromère canonique.
3. De nombreuses interactions protéine/protéine sont dues au domaine PX comme :
- Vamp7 et le complexe d'amarrage HOPS (Purification of active HOPS complex reveals its affinities for phosphoinositides and the SNARE Vam7p 2006),
- phospholipases PLD1 et PLD2 à la dynamine (The phox homology domain of phospholipase D activates dynamin GTPase activity and accelerates EGFR endocytosis 2006),
- Munc18-1 (Munc-18-1 Inhibits Phospholipase D Activity by Direct Interaction in an Epidermal Growth Factor-reversible Manner 2004),
- PKCζ (Novel Functions of the Phospholipase D2-Phox Homology Domain in Protein Kinase Cζ Activation 2005),
- p47phox avec la moésine (p47phox PX domain of NADPH oxidase targets cell membrane via moesin-mediated association with the actin cytoskeleton 2004) et cPLA2 (Cytosolic Phospholipase A2α Is Targeted to the p47phox-PX Domain of the Assembled NADPH Oxidase via a Novel Binding Site in Its C2 Domain 2008),
- SNX20 avec PSGL-1(SLIC-1/sorting nexin 20: A novel sorting nexin that directs subcellular distribution of PSGL-1 2008)…
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation



 SNX3 et rétromère
SNX3 et rétromère