Transport membranaire
Transports sans mouvements membranaires
Transporteurs actifs :
pompes (transporteurs primaires)
Transporteurs ABC : mécanismes
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le cycle catalytique des transporteurs ABC (ATP-Binding Cassette transporter) se déroule en plusieurs étapes et plusieurs modèles ont été proposés.
(Figure : vetopsy.fr d'après Beek et coll)
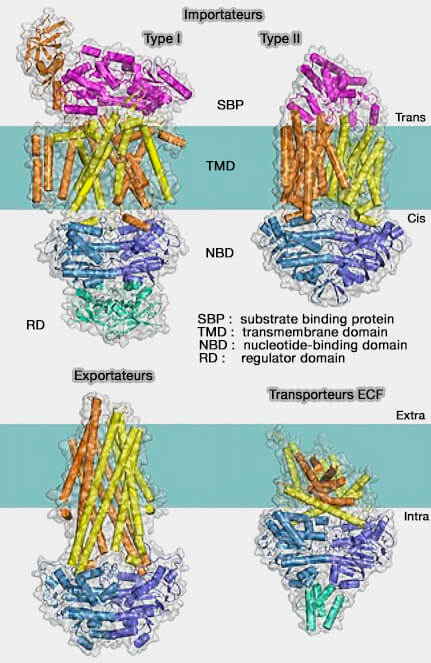
Les transporteurs ABC sont classés en deux groupes :
1. les exportateurs,
2. les importateurs subdivisés en trois sous-groupes :
- les classes I et II,
- la classe III ou famille de facteurs de couplage d'énergie (ECF, Energy Coupling Factor) structurellement et fonctionnellement distincte.
Liaison du substrat
1. Les importateurs ABC de type I et II dépendent de domaines de liaison au substrat solubles (SBD) ou de protéines de liaison au substrat (SBP) supplémentaires.
Ces structures capturent le substrat transporté du côté trans et le transmettent aux domaines transmembranaires ou TMD (A structural classification of substrate-binding proteins 2010).
Dans certains cas, le SBD est fusionné avec un TMD en une sous-unité multi-domaine (ABC transporter architecture and regulatory roles of accessory domains 2006).
2. Les transporteurs ECF et les exportateurs n'exigent pas de SBP (A Novel Class of Modular Transporters for Vitamins in Prokaryotes 2009).
Certains scientifiques prétendent qu'ils utilisent un autre mécanisme, celui du toppling, i.e. " renversement " (Structural insight in the toppling mechanism of an energy-coupling factor transporter 2016).
Vue d'ensemble des
mécanismes du transport
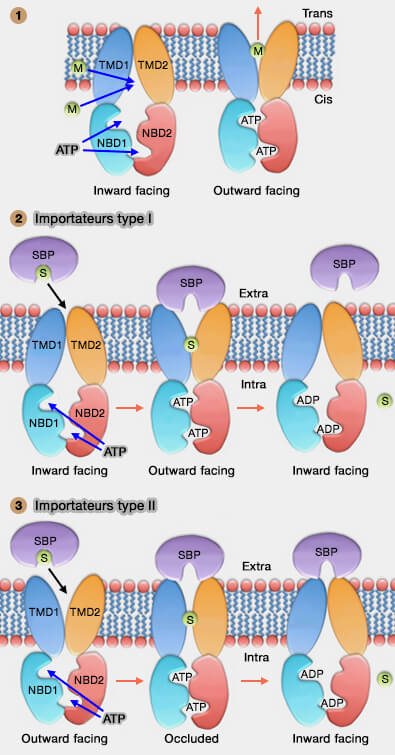
Le cycle catalytique des transporteurs ABC suit plusieurs étapes et plusieurs modèles ont été proposés (Structure and mechanism of ABC transporters 2015) :
- le modèle du site alternatif ou alternating site (The catalytic cycle of P-glycoprotein 1995),
- le modèle du commutateur ou switch (The ATP switch model for ABC transporters 2004),
- le modèle du contact continu ou constant contact (Characterization of an Asymmetric Occluded State of P-glycoprotein with Two Bound Nucleotides 2010).

Des avancées récentes sont à lire dans : Mechanics and Pharmacology of Substrate Selection and Transport by Eukaryotic ABC Exporters (2020).
(Figure : vetopsy.fr d'après Wilkens)
1. Toutefois les étapes générales sont relativement identiques :
- liaison de molécules de 2 Mg++-ATP aux domaines NBD (Nucleotide Binding Domain),
- changements conformationnels des TMD pour permettre le passage des substrats,
- hydrolyse de l'ATP,
- libération de phosphate, d'ADP et de substrats,
- dissociation des NBD avec retour ultérieur à l'état basal.
2. Ce cycle général peut être adapté à la plupart des protéines ABC, mais de nombreux points restent à éclaircir.
La figure ci-contre représente trois configurations différentes.
Mécanisme des exportateurs
Mécanisme général
L'exportateur orienté vers l'intérieur lie le substrat localisé dans le cytoplasme ou le feuillet interne de la bicouche lipidique.
1. Après la liaison de deux molécules de Mg++-ATP, les NBD se dimérisent et commutent le TMD de la conformation tournée vers l'intérieur (inward facing) à celle tournée vers l'extérieur (outward facing).
2. Cette conformation permet la libération du médicament dans le milieu extracellulaire.
3. L'hydrolyse de l'ATP, la libération de l'ADP/Pi et la dissociation du NBD réinitialisent le transporteur à la conformation tournée vers l'intérieur.

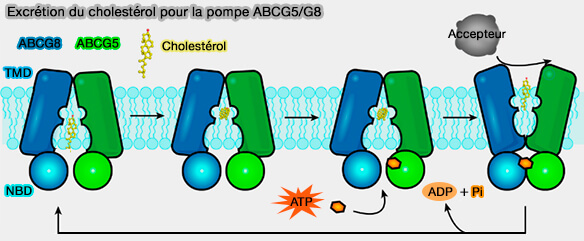
Toutefois, certains exportateurs fonctionnent de manière un peu différente !
Les mécanismes hypothétiques de certains exportateurs humains dans le transfert du cholestérol sont expliqués dans des chapitres spéciaux pour :
(Figure : vetopsy.fr d'après Sun et coll)
Exemple de la glycoprotéine P
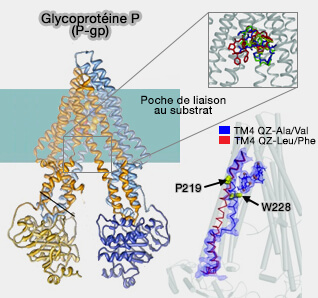
La glycoprotéine P (P-gp ou Permeability-GlycoProtein, MDR1 ou MultiDrug Resistance protein 1, ABCB1 ou ATP-Binding Cassette sub-family B member, CD243 ou Cluster of Differentiation 243) est une pompe dépendante de l'ATP de grande spécificité de substrat.
(Figure : vetopsy.fr d'après Szewczyk et coll)
1. Cette protéine est impliquée dans le transport de nombreux médicaments dans la bile (
a. Elle confère une grande résistance des cellules cancéreuses aux traitements, d'où son nom (Rôle de la glycoprotéine P dans les interactions médicamenteuses au niveau de la barrière hémato-encéphalique : données de la pharmacovigilance française 2017).
b. Elle interviendrait aussi dans le transport entérocytaire du cholestérol, aussi bien au niveau basolatéral qu'apical (
2. Sa structure est dimérique et chaque dimère est formé d'un TMD de 6 hélices et d'un NBD avec des boucles d'interconnexion et des hélices courtes (Pharmaceutical Formulations with P-Glycoprotein Inhibitory Effect as Promising Approaches for Enhancing Oral Drug Absorption and Bioavailability 2021).
- Les TMD entourent une poche centrale qui comprend plusieurs sites de liaison aux ligands. La liaison du ligand provoque un changement conformationnel important dans le TM4 qui transmet le signal aux NBD (Snapshots of Ligand Entry, Malleable Binding and Induced Helical Movement in P-Glycoprotein 2015).
- Les mutations dans cette région perturbent le transport du substrat (Structural Basis for Gating Mechanisms of a Eukaryotic P - Glycoprotein Homolog 2014).
Remarque : il semblerait que le modèle du cycle de transport de la glycoprotéine P soit celui dans lequel la dimérisation des deux sites de liaison à l'ATP constitue le power stroke (Molecular structure of human P-glycoprotein in the ATP-bound, outward-facing conformation 2018).
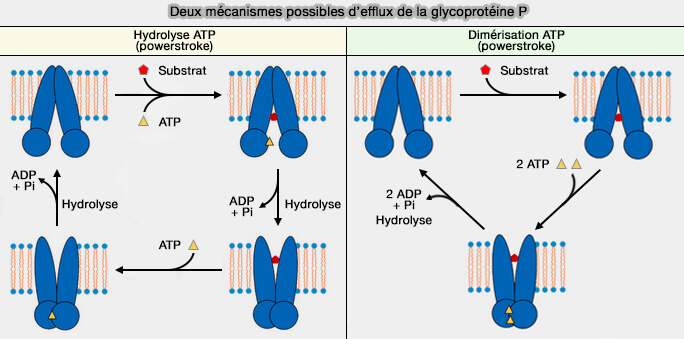
(Figure : vetopsy.fr d'après Nguyen et coll)
Mécanisme des importateurs
1. L'importateur de type I, dans la conformation tournée vers l'intérieur, i.e. MalFGK2, transporteur du maltose, se lie au substrat contenant la protéine de liaison périplasmique et à deux molécules de Mg++-ATP (Transmembrane Signaling in the Maltose ABC Transporter MalFGK2-E 2009).
- Les NBD se dimérisent et changent leur conformation, maintenant orientée vers l'extérieur. Le substrat quitte la protéine de liaison et se lie aux TMD.
- L'hydrolyse de l'ATP et la libération du produit, associée à la dissociation du NBD, réinitialisent le transporteur à la conformation tournée vers l'intérieur.
(Figure : vetopsy.fr d'après Weng et coll)
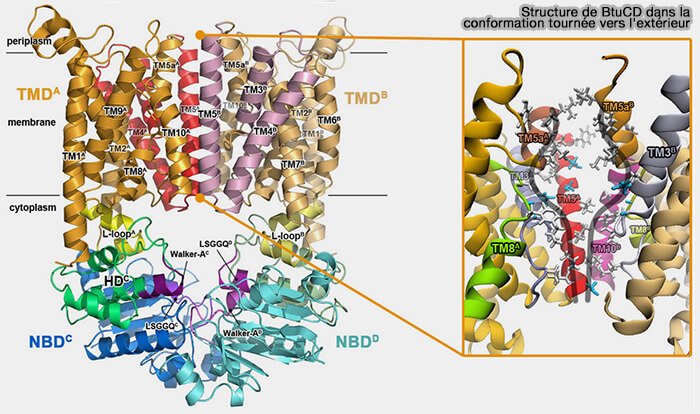
2. L'importateur de type II, orienté vers l'extérieur, i.e. BtuCD, le transporteur de la vitamine B12) se lie à la protéine de liaison au substrat (SBP) et à deux molécules de Mg++-ATP (The Conformational Transition Pathways of ATP-Binding Cassette Transporter BtuCD Revealed by Targeted Molecular Dynamics Simulation 2012).
- La dimérisation des NBD aboutit à la conformation occluse avec le substrat confiné dans une cavité centrale fermée.
- L'hydrolyse de l'ATP et la dissociation du NBD permettent au substrat de s'échapper dans le cytoplasme.
Retour vers les pompes
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireTransport membranaireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMécanismes des transporteursRocker-switchRocking-bundleElevatorTrafic vésiculaireMoteurs moléculairesVoies de signalisation


